将标准状况下的HCl气体4.48 L溶于水形成100 mL溶液,然后与足量的铁屑充分反应。计算:(1)所得盐酸溶液的物质的量浓度。
(2)参加反应的铁的质量。
(3)生成的H2的体积(标况)。
(4)将生成的FeCl2配成400 mL溶液,此溶液中FeCl2的物质的量浓度是多少?
某仅由碳、氢、氧三种元素组成的有机化合物,经测定其相对分子质量为90。取有机物样品1.8 g,在纯氧中完全燃烧,将产物先后通过浓硫酸和碱石灰,两者分别增重1.08 g和2.64 g。试求该有机物的分子式
(12分) 通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%。
(1)X的分子式是________________;
(2)X与金属钠反应放出氢气,反应的化学方程式是
________________________________________________(有机物用结构简式表达);
(3)X与空气中的氧气在铜或银催化下反应生成Y,Y的结构简式是_________________;
(4)X与高锰酸钾酸性溶液反应可生成Z。在加热和浓硫酸作用下,X与Z反应可生成一种有香味的物质W,若184 g X和120 g Z反应能生成106 g W,计算该反应的产率。(要求写出计算过程)
将一块铜板浸泡在一定浓度的FeCl3溶液中一段时间后取出,得到一混合溶液,某校化学兴趣小组的同学为分析该混合溶液的组成,进行了如下实验:
①取50.0mL混合溶液,向其中加入足量的AgNO3溶液,得白色沉淀,过滤、干燥、称量,沉淀质量为86.1 g;
②另取50.0mL混合溶液,向其中加入1.40 g铁粉,结果铁粉全部溶解但未见固体析出;
③再取50.0mL混合溶液,向其中加入20.0 mL稀硝酸,得到一种无色气体,其体积换算成标准状况时为0.448 L ;
请根据以上实验中得到的数据分析计算:
(1)原FeCl3溶液物质的量浓度(反应过程中过程中溶液体积的变化忽略不计);
(2)所得混合溶液中c(Cu2+)的取值范围;
(3)若要进一步求得混合溶液中c(Cu2+)的具体数值,在只单独使用AgNO3溶液、铁粉或稀硝酸的前题下,还可测出哪些数据,必须进行哪些实验?
通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%。
(1)X的分子式是________________;
(2)X与金属钠反应放出氢气,反应的化学方程式是_____________________________(有机物用结构简式表达);
(3)X与高锰酸钾酸性溶液反应可生成Z;在加热和浓硫酸作用下,X与Z反应可生成一种有香味的物质W,若184 g X和120 g Z反应能生成106 g W,计算该反应的产率。(要求写出计算过程)
高炉炼铁是冶炼铁的主要方法。
(1)从炼铁高炉口排出的尾气中含有一定量的有毒气体 (填化学式),会污染空气。100多年前,人们曾耗巨资改建高炉,结果尾气中的该物质含量并未减少。高炉炼铁的主要反应方程式为(设铁矿石用磁铁矿) 。
(2)已知:①4Fe(s) + 3O2=2Fe2O3(s) ΔH1
②4Fe3O4(s)+O2(g)=6Fe2O3(s) ΔH2
③3Fe(s)+2O2(g)=Fe3O4(s) ΔH3
则ΔH2= (用含上述ΔH的代数式表示)。
(3)高铁酸钠(Na2FeO4)是铁的一种重要化合物,可用电解法制备,阳极材料为铁,其电解质溶液应选用_______ (填H2SO4、HNO3、KOH、NaOH、Na2SO4)溶液,原因是_____________,阳极反应式为_________________。
(4)某温度下,HX的电离平衡常数K为1×10-5。计算该温度下0.100mol/L的HX溶液的 H+浓度。(平衡时HX的浓度以0.100mol/L计,水的电离忽略不计,写出计算过程。)
(1)1 L Na2SO4溶液中,如果含钠元素的质量是2.3 g,溶液中 SO42- 物质的量浓度为___________ mol/L。
(2)如果实验室没有 Na2SO4,可用 NaOH 和 H2SO4反应配制 Na2SO4溶液,从理论上计算,配制符合(1)的要求的 Na2SO4溶液,需要NaOH的质量为________g 和 1.0 mol/L硫酸溶液的体积为 _______ mL。(说明:按计算用量混合后,用蒸馏水稀释至1 L
_______ mL。(说明:按计算用量混合后,用蒸馏水稀释至1 L 即可)
即可)
世界卫生组织把铝列为食品污染源之一,成人每日摄入铝元素的量应控制在0.004 g以下。油条是中国北方常用的食品之一,每270 g油条中约含0.9 g明矾〔KAl(SO4)2·12H2O,其相对分子质量为474〕。试通过计算说明,若成人每日食用142.2 g油条,铝元素的摄入量是否会超过安全摄入量?
为了消除人体碘缺乏病,我国政府规定食用盐必须是加碘食盐,简称碘盐。所谓碘盐就是在食盐中加入一定量的碘酸钾(KIO3),请计算(精确到0.1):
(1)碘酸钾中碘元素的质量分数。
(2)若成人每天食用7 g碘盐,从中摄取0.15 mg碘,那么1 kg碘盐中含碘多少毫克?
(3)我国规定每千克食盐中碘酸钾的含量在0.06—0.08 g。某研究小组称取食盐样品100 g,加入足量碘化钾发生反应:KIO3+5KI+3H2SO4====3K2SO4+3I2+3H2O,测得生成碘单质0.0254 g,请计算1 000 g样品中KIO3的含量,并判断样品是否符合国家标准。
通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%
(1)X的分子式是________________;
(2)X与金属钠反应放出氢气,反应的化学方程式是___________________________(有机物用结构简式表达);
(3)X与空气中的氧气在铜或银催化下反应生成Y,Y的结构简式是_________________;
(4)X与高锰酸钾酸性溶液反应可生成Z。在加热和浓硫酸作用下,X与Z反应可生成一种有香味的物质W,若184 g X和120 g Z反应能生成106 g W,计算该反应的产率。(要求
写出计算过程)
将等物质的量的NaCl和CuSO4的溶解于水配成200mL混合溶液,通电电解到阴极刚有气体放出时停止电解,将阳极产生的气体在一定条件下恰好与5.6L标况下的H2反应。试求原溶液中两种溶质的物质的量浓度。
在2 L和密闭容器中放入4mol ,发生如下反应:
,发生如下反应: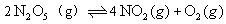 ,反应进行到5min时,测得
,反应进行到5min时,测得 转化了20%,求:
转化了20%,求:
(1)5min时,剩余 的物质的量;
的物质的量;
(2)前5min,v( )为多少;
)为多少;
(3)5min时,O2的物质的量占混合气体总物质的量的百分比。
(8分)从100ml某种待测浓度的Na2CO3溶液中取出50ml,加入含HCl0.4mol的盐酸溶液,恰好完全反应。
(1)生成CO2的物质的量是多少?
(2)待测Na2CO3溶液的物质的量浓度是多少?
某种烃A的蒸气折合成标况下的密度是3.214g/L,已知该烃的碳氢质量比为5∶1,求:
(1)该烃的相对分子质量 (2)确定该烃的分子式
(3)如果该烃的一氯取代物有4种,写出该烃的结构简式
(4)烃A可由另一种烃B通过加成反应而制得,则烃B的可能的是(任写一种可能的结构简式)