湖北省恩施高二下学期期末测试化学卷
下列措施不能达到节能减排目的的是
| A.利用太阳能制氢燃料 | B.用家用汽车代替公交车 |
| C.利用潮汐能发电 | D.用节能灯代替白炽灯 |
Cu2O是一种半导体材料,基于绿色化学理念设计的制取.Cu2O的电解池示意图如下,点解总反应:2Cu+H2O==Cu2O+H2O 。下列说法正确的是 ( )
。下列说法正确的是 ( )
| A.石墨电极上产生氢气 |
| B.铜电极发生还原反应 |
| C.铜电极接直流电源的负极 |
| D.当有0.1mol电子转移时,有0.1molCu2O生成。 |
下列说法正确的是 ( )
| A.增大压强,活化分子数增加,化学反应速率一定增大 |
| B.升高温度,活化分子百分数增加,化学反应速率一定增大 |
| C.活化分子间所发生的分子间的碰撞为有效碰撞 |
| D.加入反应物,使活化分子百分数增加,化学反应速率增大 |
物质的量浓度相同的下列溶液,pH由大到小排列正确的是 ( )
| A.Ba(OH)2、 Na2SO3、FeCl3、KCl |
| B.Na2SiO3、Na2SO3、KNO3、NH4Cl |
| C.NH3·H2O、H3PO4、Na2SO4、H2SO4 |
| D.NaHCO3、C6H5COOH、C2H5OH、HCl |
25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是 ( )
A.2H+(aq) + (aq)+ (aq)+ (aq)+2OH (aq)+2OH (aq)=BaSO4(s)+2H (aq)=BaSO4(s)+2H O(1); O(1); H= H= 57.3 kJ/mol 57.3 kJ/mol |
B.KOH(aq)+ H H SO4(aq)= SO4(aq)=  K K SO4(aq)+H SO4(aq)+H O(I); O(I); H= H= 57.3kJ/mol 57.3kJ/mol |
C.C8H18(I)+  O O (g)=8CO (g)=8CO (g)+ 9H (g)+ 9H O; O; H= H= 5518 kJ/mol 5518 kJ/mol |
D.2C8H18(g)+25O (g)=16CO (g)=16CO (g)+18H (g)+18H O(1); O(1); H= H= 5518 kJ/mol 5518 kJ/mol |
人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2 O2+HbCO ,37 ℃时,该反应的平衡常数K="220" 。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是
O2+HbCO ,37 ℃时,该反应的平衡常数K="220" 。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是 ( )
( )
A.CO与HbO2反应的平衡常数K= |
| B.人体吸入的CO越多,与血红蛋白结合的O2越少 |
| C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损 |
| D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动 |
能正确表示下列反应的离子方程式是( )
| A.足量硫化氢气体通入硫酸铁溶液中:H2S+Fe3+=Fe2++S↓+2H+ |
| B.足量铁与稀硝酸反应:Fe+4H++NO3-=Fe2++2H2O+NO↑ |
| C.醋酸溶液与纯碱反应:CO32-+2H+=+H2O+CO2↑ |
| D.等物质的量的Ba(OH)2与NaHSO4在溶液中反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
下列各离子组,因发生氧化还原反应而不大量共存的是 ( )
| A.K+ Na+ HSO3- NO3- |
| B.Mg2+ Al3+ SO42- OH- |
| C.K+ Fe2+ Cl- S2- |
| D.K+ Ba2+ NO3- SO32- |
25℃某一元强酸的体积为Va、pH=a,和体积为Vb、pH=b为的一元强碱混合后的pH为7,已知Va<Vb,且a=0.5b,则b的取值范围是 ( )
| A.7/2<b<14/3 | B.7<b<28/3 | C.8<b<13 | D.9 <b<12 |
江苏中国矿业大学一名大学生用铊盐进行投毒事件,引起警方高度重视。铊(TI)的毒性高于铅和汞,在生产鞭炮(花炮)的原料中往往也含有高量的铊元素,长时间在鞭炮爆炸物氛围中也会引起中毒。铊属ⅢA族元素。下列推断或说法不正确的是 ( )
| A.以惰性电极电解TlCl3溶液可得到金属铊 |
| B.铊盐对环境有危害,对水体可造成污染 |
| C.铊的电负性比铝小 |
| D.同物质的量浓度时AlCl3水溶液酸性比TlCl3强 |
如图所示,一定条件下将1mol A2气体和3molB2气体充入一容积可变的密闭容器中,可滑动的活塞的位置如图1所示。在恒温恒压下发生如下反应:A2+3B2 2AB3。当反应达到平衡时,活塞位置如图2所示,则平衡时A的转化率是 ( )
2AB3。当反应达到平衡时,活塞位置如图2所示,则平衡时A的转化率是 ( )
| A.20% | B.40% | C.60% | D.无法确定 |
向体积为0.05mol·L-1CH3COOH溶液中加入体积为Vb的0.05mol·L-1KOH溶液,下列关系错误的是 ( )
| A.Va>Vb时:c (CH3COOH) +c (CH3COO-)>c (K+) |
| B.Va=Vb时:c (CH3COOH) +c (H+)>c (OH-) |
| C.Va<Vb时:c (CH3COO-)>c (K+)> c (OH-)> c (H) |
| D.Va与Vb任意比时:c (K+)+ c (H+)=c (OH-)+ c (CH3COO-) |
相同条件下,下列装置中指定电极的电极反应式相同的是( )
| A.②④⑥⑦⑩ | B.①③⑤⑧⑨ | C.②③④⑤⑥⑦⑩ | D.①③⑤⑦⑨ |
以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述正确的是 ( )
| A.该电池能够在高温下工作 |
| B.电池的负极反应为: |
C.放电过程中, 从正极区向负极区迁移 从正极区向负极区迁移 |
D.在电池反应中,每消耗1mol氧气,理论上能生成标准状况下 气体 气体 |
可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是 ( )
| A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-=4OH- |
| B.以NaOH溶液为电解液时,负极反应为:Al+3OH--3e-=Al(OH)3↓ |
| C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变 |
| D.电池工作时,电子通过外电路从正极流向负极 |
某实验小组设计用50 mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在下图装置中进行中和反应。在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过。通过测定反应过程中所放出的热量可计算中和热。试回答下列问题:
(1)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和。试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热数值 (填偏高、偏低或不变);
(2)该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据。
| 实验序号 |
起始温度t1/℃ |
终止温度(t2)℃ |
温差(t2-t1)℃ |
||
| 盐酸 |
NaOH溶液 |
平均值 |
|||
| 1 |
25.1 |
24.9 |
25.0 |
31.6 |
6.6 |
| 2 |
25.1 |
25.1 |
25.1 |
31.8 |
6.7 |
| 3 |
25.1 |
25.1 |
25.1 |
31.9 |
6.8 |
已知盐酸、NaOH溶液密度近似为1.00g/cm3中和后混和液的比热容 C=4.18J(g.·℃)则该反应的中和热为△H=___________________________________;
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热的数值会 (填偏高、偏低或不变),其原因是 ;
(4)影响中和热测定结果的关键因素在于:
为减小实验误差,可采取的措有: 。
超音速飞机在平流层飞行时,尾气中的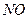 会破坏臭氧层。科学家正在研究利用催化技术将尾气中的
会破坏臭氧层。科学家正在研究利用催化技术将尾气中的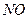 和
和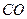 转变成
转变成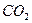 和
和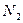 ,化学方程式如下:
,化学方程式如下:
2NO+2CO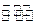 2CO2 + N2;为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2 + N2;为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表: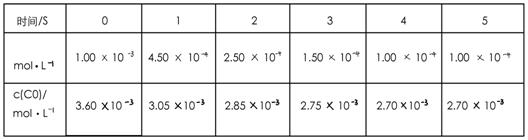 请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的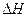 0(填写“>”、“<”、“=”。
0(填写“>”、“<”、“=”。
(2)前2s内的平均反应速率v(N2)=_____________。
(3)在该温度下,反应的平衡常数K= 。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是 。
| A.选用更有效的催化剂 | B.升高反应体系的温度 |
| C.降低反应体系的温度 | D.缩小容器的体积 |
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
| 实验编号 |
T/OC |
NO初始浓度/mol·L-1 |
CO初始浓度/mol·L-1 |
催化剂的比表面积/m2·g-1 |
| I |
280 |
1.20×10-3 |
5.80×10-3 |
82 |
| II |
|
|
|
124 |
| III |
350 |
|
|
124 |
①请在上表格中填入剩余的实验条件数据。
②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线是实验编号。
某溶液中可能含有Na+、K+、Mg2+、I—、SO32—、SO42—等离子中的全部或其中的几种。现分别进行以下实验操作:①用洁净的铂丝蘸取溶液在无色火焰上灼烧,焰色呈黄色;②取原溶液,滴加少量溴水,振荡后溶液仍为无色。③取原溶液,加入盐酸酸化的Ba(NO3)2溶液后,产生白色沉淀。
(1)原溶液中一定存在的离子是 ,一定不存在的离子是 。
(2)上述①~③,的操作中, 是错误的,应改为 ,以便确定 离子的存在。
(3)为确定 离子是否存在,应补充的实验是① ② 。
Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。
(1)该电池的负极材料是 。电池工作时,电子流向 (填“正极”或“负极”)。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是 。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是 。若电解电路中通过2mol电子,MnO2的理论产量为 。
有五种短周期主族元素A、B、C、D、E,已知:五种元素原子序数依次增大,其中A、E的单质在常温下是气体,B元素原子的最外层电子数是电子层数的2倍,D元素的单质常用于野外焊接铁轨,C元素是所在周期主族元素中原子半径最大的一种。
(1)试写出A、B两种元素形成的不含有非极性键的化合物的电子式: ;
(2)试写出工业上用电解方法冶炼D单质的化学方程式 ;
(3)写出C单质在空气中燃烧的化学方程式,并标出电子转移的方向和数目: ;
(4)写出实验室制取单质E的化学方程式: 。
现有A、B、C、D、E、F六种化合物,已知它们的阳离子有 ,
, 阴离子有
阴离子有 ,现将它们分别配成
,现将它们分别配成 的溶液,进行如下实验:
的溶液,进行如下实验:
①测得溶液A、C、E呈碱性,且碱性为A>E>C;
②向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
③向D溶液中滴加 溶液,无明显现象;
溶液,无明显现象;
④向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
根据上述实验现象,回答下列问题:
(1)实验②中反应的化学方程式是
;
(2)E溶液是 ,判断依据是
;
(3)写出下列四种化合物的化学式:A 、C 、
D 、F .
2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
(1)图中A、C分别表示 、 ,E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是 ;
(2)图中△H= KJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式 ;
(4)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)= mol·L-1·min-1、υ(SO3)= mol·L-1·min-1;
(5)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H (要求计算过程)。
将等物质的量的NaCl和CuSO4的溶解于水配成200mL混合溶液,通电电解到阴极刚有气体放出时停止电解,将阳极产生的气体在一定条件下恰好与5.6L标况下的H2反应。试求原溶液中两种溶质的物质的量浓度。
将一块铜板浸泡在一定浓度的FeCl3溶液中一段时间后取出,得到一混合溶液,某校化学兴趣小组的同学为分析该混合溶液的组成,进行了如下实验:
①取50.0mL混合溶液,向其中加入足量的AgNO3溶液,得白色沉淀,过滤、干燥、称量,沉淀质量为86.1 g;
②另取50.0mL混合溶液,向其中加入1.40 g铁粉,结果铁粉全部溶解但未见固体析出;
③再取50.0mL混合溶液,向其中加入20.0 mL稀硝酸,得到一种无色气体,其体积换算成标准状况时为0.448 L ;
请根据以上实验中得到的数据分析计算:
(1)原FeCl3溶液物质的量浓度(反应过程中过程中溶液体积的变化忽略不计);
(2)所得混合溶液中c(Cu2+)的取值范围;
(3)若要进一步求得混合溶液中c(Cu2+)的具体数值,在只单独使用AgNO3溶液、铁粉或稀硝酸的前题下,还可测出哪些数据,必须进行哪些实验?
 粤公网安备 44130202000953号
粤公网安备 44130202000953号