常温下电解200 mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:
(1)原混合溶液NaCl和CuSO4的物质的量浓度。
(2)t2时所得溶液的c(H+)。
(3)电解至t3时,消耗水的质量。
标准状况下1.68 L无色可燃气体在足量氧气中完全燃烧。若将产物通入足量澄清石灰水中,得到的白色沉淀质量为15.0 g;若用足量碱石灰吸收燃烧产物,质量增加9.3 g。
(1)燃烧产物中生成水的质量是______________________________。
(2)若原气体是单一气体,则它的分子式是___________________________。
(3)若原气体是两种等物质的量的气体的混合物,其中只有一种是烃,请写出它们的分子式(只要求写出一组)___________________________。
(6分)24mLNO和NO2混合气体的试管倒置于水中,待液面上升到位置不再改变时,试管内气体总体积缩小一半。
(1) 原混合气体中NO和NO2的体积比为
(2) 若在剩余气体中通入3mLO2 ,则有 mL水进入试管?
(3) 若在原24mL混合气体中通入 mLO2,并倒置于水中,溶液将充满整个试管。
有一硫酸与硝酸的混合溶液100 ml,取出10 mL加入足量BaCl2溶液,过滤、洗涤、烘干后得到9.32g的沉淀;滤液与4.0 mol•L-1NaOH溶液反应,用去35 mL碱液时恰好完全中和。试求:原混合液中H2SO4的物质的量浓度是多少?HNO3的物质的量是多少?
为了测定某铜银合金的成分,将30.0g合金溶于80mL13.5mol/L的浓硝酸中,待合金完全溶解后,收集到6.72L(标准状况)NO和NO2的混合气体,并测得溶液中H+浓度为1mol/L。假设反应后溶液的体积仍为80mL,试计算.
(1)被还原硝酸的物质的量。 (2)合金中银的质量分数。
现有两份铵盐样品A、B,其成分都是(NH4)2SO4、NH4HSO4的混合物。甲、乙两个研究性学习小组的同学想要确定A和B中各成分的含量。
甲组同学取了数分相同质量的样品A溶于水,然后分别加入不同体积的1mol/L的NaOH溶液,水浴加热至气体全部逸出。(此温度下,铵盐不分解)。该气体干燥后用足量的浓硫酸完全吸收。浓硫酸增重的质量与加入NaOH溶液的体积的关系如图。分析该图像,并回答下列问题:
(1)写出ab段涉及的离子方程式: 。
(2)c点对应的数值是 ;样品A中(NH4)2SO4、NH4HSO4的物质的量之比为 。乙组同学取了数份不同质量的样品B,分别加入到200mL 1mol/L的NaOH溶液中,同样用水浴加热,将逸出气体干燥后再用浓H2SO4吸收。测定结果如下表:
| 实验编号 |
Ⅰ |
Ⅱ |
Ⅲ |
Ⅳ |
| 铵盐的质量(g) |
9.88 |
19.76 |
29.64 |
49.40 |
| 浓硫酸增加的质量(g) |
m |
m |
1.36 |
0 |
分析该表,并回答下列问题:
(3)①分析实验数据可知,实验编号为 的实验中,氢氧化钠足量,铵盐中的铵根离
子完全转化成气体;m的值为 。
②计算样品B中氮元素的质量分数。(用小数表示,保留两位小数)
(1)乙组同学在研究时发现,浓硫酸增重的质量与样品B的质量之间满足一定的函数关系。假设样品的质量为x(g),浓硫酸增重的质量为y(g)。求:当x在不同范围时y与x的函数关系。
已知反应:6NO + 4NH3= 5N2+ 6H2O
(1)氧化产物与还原产物的质量比为多少?
(2)现有NO与NH3的混合物1mol,充分反应后所得产物中,经还原得到的N2比经氧化得到的N2多1.4g。若以上反应进行完全,试计算原反应混合物中NO与NH3的物质的量可能各是多少。
(3)将标准状况下的a L NH3(g)溶于0.1L水中,得到的氨水密度为b g•cm﹣3,则该氨水的物质的量浓度是多少?
下图为某浓盐酸试剂瓶标签上的部分数据.请列式计算回答下列问题:
(1)该浓盐酸的物质的量浓度是多少?
(2)500mL该盐酸中溶解了标准状况下的HCl气体多少升?
(3)用该浓盐酸,与蒸馏水配制成体积比为1:4的稀盐酸,则所配制稀盐酸的质量分数为多少?(计算结果保留3位有效数字)
一定质量的某金属 X和足量的稀H2SO4反应共有0.3mol电子发生转移,生成6.02×1022个
X和足量的稀H2SO4反应共有0.3mol电子发生转移,生成6.02×1022个  Xn+ ,这些阳离子共有1.3×6.02×1023个质子、1.4×6.02×1023个中子。
Xn+ ,这些阳离子共有1.3×6.02×1023个质子、1.4×6.02×1023个中子。
(1)求Z、n和A的值。(写过程)
(2)写出该金属与NaOH溶液反应的化学方程式。
(本题共14分)金属除了可以形成氧化物,氢化物之外,还能以碳化物、氮化物等形式存在,请根据题意完成下列计算:
57、某CaC2样品中含碳量为25%(杂质不含碳),该CaC2样品中CaC2的质量分数为 。
58、已知2Mg3N2+3CO2 → 3C+6MgO+2N2,10.0g Mg3N2与标准状况下4.48L CO2反应,固体质量增加 g。
第IIA族碳化物Be2C与CaC2组成的混合物与一定量的水反应,相关数据如下:
| 实验组号 |
① |
② |
③ |
④ |
| 碳化物(g) |
6.2 |
9.3 |
15.5 |
21.7 |
| 水(mL) |
18 |
18 |
18 |
18 |
| 气体(L,标准状况) |
3.36 |
5.04 |
8.4左右 |
8.4左右 |
59、求该混合物中Be2C与CaC2的物质的量之比 。
60、与18mL水恰好完全反应消耗该金属碳化物样品的质量是多少克?(保留一位小数)
(6分)把2.0mol/L CuSO4溶液和2.0mol/L H2SO4溶液等体积混合(假设混合后溶液的体积等于混合前两种溶液的体积之和)。计算:(不必写过程,直接将答案填写在答题卡上)
(1)混合溶液中H+、Cu2+、SO42-的物质的量浓度;
(2)向溶液中加入铁粉,足够长的时间后,铁粉有剩余,过滤,此时滤液中的Fe2+的物质的量浓度;
(3)取100mL该滤液,向其中加入适量硝酸,再加入足量氢氧化钠溶液,有红褐色沉淀生成。过滤,加热沉淀物至质量不再变化,得到红棕色的残渣。写出残渣的化学式,并计算残渣的质量(不计操作带来的损失)。
(本题共14分)
49.将7.8gNa2O2加入100g水中,充分反应后得到密度为1.02g/cm3的溶液。
(1)溶液的质量分数为____________(保留3位小数)。
(2)溶液的物质的量浓度为______________mol/L(保留2位小数)。
50.有KCl、NaCl、Na2CO3的混合物,其中钠元素的质量分数为0.3150,氯为0.2708,为求算Na2CO3的质量分数,某同学列了以下关系式:(31.50÷23)+(100-31.50-27.08-x)÷39=(27.08÷35.5)+x÷60X2
解得x=28.25,则Na2CO3的质量分数为__________________(保留3位小数)。
51.含不溶杂质的NaNO3样品,加入一定量蒸馏水使其充分溶解,情况如下:
| 温度(℃) |
10 |
40 |
75 |
| 剩余固体质量(g) |
201 |
132 |
72 |
NaNO3溶解度(g/100g水)如下:
| 温度(℃ |
10 |
40 |
70 |
| 溶解度 |
81 |
104 |
150 |
(1)实验中加入的水为______________________g;
(2)原样品中NaNO3为______________________g。
52.在450℃、1.50×107Pa条件下,Na2O与O2反应生成NaO 2,NaO 2可用于应急呼吸面罩:
4NaO2+2CO 2→2Na2CO3+3O2 4NaO2+2H2O (g)+4CO2→4NaHCO3+3O2
某呼吸面罩中放置了500g NaO2,吸收CO2和H2O(g),每产生18.48L(换算为标准状况)O2时,固体的质量就增加13.30g。计算生成的Na2CO3和NaHCO3物质的量之比:
FeS2是Li/FeS2电池的正极活性物质,可用水热法合成。等物质的量的FeSO4、Na2S2O3、S及H2O在200℃连续反应24小时,再依次用CS2、H2O洗涤、干燥及晶化后得到。
(1)FeS2中硫元素的化合价为;合成FeS2离子方程式为 。
(2)用CS2、H2O洗涤除去杂质,其中用CS2洗涤的目的是 。
(3)取上述制得的正极材料1.1200g (假定只含FeS一种杂质),在足量的氧气流中充分加热,最后得0.8000g红棕色固体,则该正极材料中FeS2的质量分数(写出计算过程)。
恒温下,将xmolN2与ymolH2的混合气体通入一个容积为1L的密闭容器中,发生如下反应:N2(g)+3H2(g)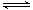 2NH3(g)。
2NH3(g)。
(1)若反应到达某时刻t时,nt(H2)=9mol,nt(NH3)=4mol,计算y的值。
(2)反应达平衡时,混合气体的体积为672L(标准状况下),其中NH3的含量(体积分数)为20%,计算平衡时NH3的物质的量及平衡常数K(保留2位有效数字)。
将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol/(L·min),且此时A的物质的量浓度为0.25mol·L-1。
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol/(L·min),且此时A的物质的量浓度为0.25mol·L-1。
求:(1)x的值是多少;
(2)B的平均反应速率;
(3)则反应开始前放入容器中A、B的物质的量。