(11分) 二甲醚是一种重要的清洁燃料,可替代氟利昂作制冷剂,对臭氧层无破坏作用。工业上可利用水煤气合成二甲醚,总反应为:
3H2(g)+3CO(g) CH3OCH3(g)+CO2(g) ΔH=-246.4 kJ/mol
CH3OCH3(g)+CO2(g) ΔH=-246.4 kJ/mol
(1)在一定条件下的密闭容器中,该总反应达到平衡,只改变一个条件能同时提高反应速率和CO的转化率的是________(填字母代号)。
a.降低温度 b.加入催化剂 c.缩小容器体积 d.增加H2的浓度 e.增加CO的浓度
(2)该反应的化学平衡常数表达式K= 。
温度升高平衡常数 (填“变大”、“变小”、“不变”)
(3)在一体积可变的密闭容器中充入3 mol H2、3 mol CO、1 mol CH3OCH3、1 mol CO2,在一定温度和压强下发生反应:3H2(g)+3CO(g)  CH3OCH3(g)+CO2(g),经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。
CH3OCH3(g)+CO2(g),经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。
问:①反应开始时正、逆反应速率的大小:v(正)________v(逆)(填“>”“<”或“=”),理由是
。
②平衡时n(CH3OCH3)=________,平衡时CO的转化率为________。
③在该反应条件下能判断反应达到化学平衡状态的依据是________(填编号)。
A v(CO)=3v(CO2) B 生成a mol CO2的同时消耗3a mol H2
C c(CO2)=c(CO) D 混合气体的平均相对分子质量不变
E.气体的密度不再改变 F.气体的总质量不再改变
碱式氧化镍(NiOOH)可用作镍氢电池的正极材料。以含镍(Ni2+)废液为原料生产NiOOH的一种工艺流程如下:
(1)加入Na2CO3溶液时,确认Ni2+已经完全沉淀的实验方法是 。
(2)已知Ksp[Ni(OH)2]=2×10-15,欲使NiSO4溶液中残留c(Ni2+)≤2×10-5 mol·L-1,调节pH的范围是 。
(3)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式: 。
(4)若加热不充分,制得的NiOOH中会混有Ni(OH)2,其组成可表示为xNiOOH·yNi(OH)2。现称取9.18 g样品溶于稀硫酸,加入100 mL 1.0 mol·L-1 Fe2+标准溶液,搅拌至溶液清亮,定容至200 mL。取出20.00 mL,用0.010 mol·L-1 KMnO4标准溶液滴定,用去KMnO4标准溶液20.00 mL,试通过计算确定x、y的值(写出计算过程)。涉及反应如下(均未配平):
NiOOH+Fe2++H+—Ni2++Fe3++H2O Fe2++MnO4-+H+—Fe3++Mn2++H2O
一定质量的某金属 X和足量的稀H2SO4反应共有0.3mol电子发生转移,生成6.02×1022个
X和足量的稀H2SO4反应共有0.3mol电子发生转移,生成6.02×1022个  Xn+ ,这些阳离子共有1.3×6.02×1023个质子、1.4×6.02×1023个中子。
Xn+ ,这些阳离子共有1.3×6.02×1023个质子、1.4×6.02×1023个中子。
(1)求Z、n和A的值。(写过程)
(2)写出该金属与NaOH溶液反应的化学方程式。
(本题14分)闪锌矿(主要成份为ZnS)是含锌主要矿物之一,高温加热闪锌矿生成ZnO和SO2。ZnO用于冶炼金属锌,SO2可制亚硫酸盐或硫酸。计算回答下列问题(保留2位小数)
56、取1.56 g闪锌矿样品,在空气中高温加热(杂质不反应),充分反应后,冷却,得到残留固体的质量为1.32 g,样品中含硫化锌的质量分数是_________。
57、取1.95 g锌加入到12.00 mL 18.4 mol/L的浓硫酸中(假设生成的气体中无氢气,浓硫酸产生单一的还原产物),充分反应后,小心地将溶液稀释到1000 mL,取出15.00 mL,以酚酞为指示剂,用0.25 mol/L的NaOH溶液滴定,耗用NaOH溶液的体积为21.70 mL。通过计算确定浓硫酸被还原的产物是________。
58、若将ZnS溶于强酸可产生硫化氢气体。在120 oC、1 atm下,将100 mL硫化氢和氧气的混合气体点燃,恢复到原来状态,测得剩余气体为70 mL,求原混合气体中硫化氢的体积分数。(不考虑硫化氢气体自身受热分解)
59、将标况下4.48 L SO2气体慢慢通入200 mL一定浓度NaOH溶液中,SO2气体全部被吸收,将反应后的溶液在空气中小心蒸干(不考虑酸式盐的分解),得到不超过两种物质的无水晶体26.8g。通过计算确定所得晶体的成分与物质的量。
将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)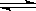 xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1mol·L-1·min-1。求:
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1mol·L-1·min-1。求:
(1)x值;
(2)B的平均反应速率;
(3)此时A的浓度及反应开始前放入容器中的A、B的物质的量。
(7分)将标准状况下4.48 L的CO2通入适量的NaOH溶液中充分反应后,溶液中生成盐的质量为19.0 g。
(1)若要使生成的盐的质量变为25.2 g,则应继续向溶液中通入CO2多少克?(写出计算过程)
(2)向生成的19.0 g的盐溶液中加入一定量某物质,充分反应后,减压低温蒸发得到纯净的21.2 g Na2CO3固体。则:
①若只能加入0.05 mol某物质,则加入的物质可以是________或________。
②若只能加入0.10 mol某物质,则加入的物质可以是________或________。
(本题共14分)金属除了可以形成氧化物,氢化物之外,还能以碳化物、氮化物等形式存在,请根据题意完成下列计算:
57、某CaC2样品中含碳量为25%(杂质不含碳),该CaC2样品中CaC2的质量分数为 。
58、已知2Mg3N2+3CO2 → 3C+6MgO+2N2,10.0g Mg3N2与标准状况下4.48L CO2反应,固体质量增加 g。
第IIA族碳化物Be2C与CaC2组成的混合物与一定量的水反应,相关数据如下:
| 实验组号 |
① |
② |
③ |
④ |
| 碳化物(g) |
6.2 |
9.3 |
15.5 |
21.7 |
| 水(mL) |
18 |
18 |
18 |
18 |
| 气体(L,标准状况) |
3.36 |
5.04 |
8.4左右 |
8.4左右 |
59、求该混合物中Be2C与CaC2的物质的量之比 。
60、与18mL水恰好完全反应消耗该金属碳化物样品的质量是多少克?(保留一位小数)
(6分)把2.0mol/L CuSO4溶液和2.0mol/L H2SO4溶液等体积混合(假设混合后溶液的体积等于混合前两种溶液的体积之和)。计算:(不必写过程,直接将答案填写在答题卡上)
(1)混合溶液中H+、Cu2+、SO42-的物质的量浓度;
(2)向溶液中加入铁粉,足够长的时间后,铁粉有剩余,过滤,此时滤液中的Fe2+的物质的量浓度;
(3)取100mL该滤液,向其中加入适量硝酸,再加入足量氢氧化钠溶液,有红褐色沉淀生成。过滤,加热沉淀物至质量不再变化,得到红棕色的残渣。写出残渣的化学式,并计算残渣的质量(不计操作带来的损失)。
将BaCl2·xH2O的晶体2.44克溶于水配成100mL溶液,取此溶液25mL与50mL0.1mol/L的AgNO3溶液作用,刚好把Cl-离子沉淀完全。①求2.44克的BaCl2·xH2O的物质的量。
②求BaCl2·xH2O的摩尔质量。③求BaCl2·xH2O的晶体的x的值。
将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol/(L·min),且此时A的物质的量浓度为0.25mol·L-1。
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol/(L·min),且此时A的物质的量浓度为0.25mol·L-1。
求:(1)x的值是多少;
(2)B的平均反应速率;
(3)则反应开始前放入容器中A、B的物质的量。
将a g铁粉和b g硫粉混合均匀,在隔绝空气条件下充分加热,然后往反应后的固体混合物中加入足量稀硫酸。若使产生的气体充分燃烧,消耗标准状况下空气的体积为VL(空气中O2的体积分数为0.20)。请通过计算分析V的取值范围。
某中学化学兴趣小组为了测定某矿山石灰石中碳酸钙的质量分数,取石灰石样品与足量的10%的稀盐酸在烧杯中反应(假设石灰石样品中杂质不与稀盐酸反应也不溶于水)。有关实验数据如下表:
| |
反应前 |
反应后 |
|
| 实验 数据 |
烧杯和稀盐酸的质量 |
石灰石样品的质量 |
烧杯和其中混合物的质量 |
| 134.4 g |
10 g |
141.1 g |
请计算(写出计算过程):
(1)该石灰石中碳酸钙的质量分数;
(2)参加反应10%的盐酸的质量。
某科研人员设计出将硫酸渣(主要成分Fe2O3,含有少量的SiO2等杂质)再利用的流程。流程中的滤液经过多次循环后用来后续制备氧化铁粉末。

(1)为了加快反应①的反应速率,可采用的措施是 。(写出一点即可)
(2)“还原”是将Fe3+转化为Fe2+。在温度T1 、T2(T1 >T2)下进行该反应,通过检测相同时间内溶液的pH,绘制pH随时间的变化曲线如右所示。得出结论:该反应的温度不宜过高。

①通入SO2气体“还原”时, 试解释pH下降的原因是 。
②相同时间内,T1温度下溶液的pH更高的原因是 。
(3)该流程中循环使用的物质是 。
(4)为测定反应①后溶液中Fe3+的浓度以控制加入SO2的量。实验步骤为:准确量取20.00ml的反应后溶液,稀释成100mL溶液,取10.00 mL溶液,加入足量的KI晶体和2~3滴淀粉溶液,用0.50mol/L的Na2S2O3溶液与碘反应,当反应恰好完全进行时,共消耗Na2S2O3溶液20.00 mL。有关反应方程式如下:
2Fe3++2I-=2Fe2++I2;2Na2S2O3 + I2= Na2S4O6 + 2NaI
试计算原溶液中Fe3+的物质的量浓度(写出计算过程)。
在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)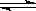 M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
| 实验 编号 |
温度/℃ |
起始时物质的量/mol |
平衡时物质的量/mol |
|
| n(X) |
n(Y) |
n(M) |
||
| ① |
700 |
0.40 |
0.10 |
0.090 |
| ② |
800 |
0.10 |
0.40 |
0.080 |
| ③ |
800 |
0.20 |
0.30 |
a |
请计算:
(1)实验①中,若5min时测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速率υ(N);
(2)实验②中,该反应的平衡常数K ;
(3)实验③中,达到平衡时,X的转化率 。
已知羟基直接连在不饱和碳原子上的结构是不稳定的。A、B二种有机物互为同分异构体。已知A相对分子质量是58。1.16gA完全燃烧,将生成物通过浓硫酸,浓硫酸增重1.08g,再通过碱石灰,碱石灰增重2.64g。若A能发生银镜反应,B能使溴水褪色并且还能与钠反应生成氢气。
求:
(1)A的分子式
(2)写出A、B两种物质的结构简式。