(1、2、3班必做)Al单质的晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。
若已知Al的原子半径为d pm,NA代表阿伏加德罗常数,Al的相对原子质量27。通过计算确定
(1)一个晶胞中Al原子的数目。
(2)Al晶胞的密度表达式。
常温下,将1.92 g铜加入到100 mL H2SO4和HNO3的混合液中,Cu全部溶解,放出无色气体,再向溶液中加入足量铁粉,充分反应,此时收集到气体为448 mL 的氢气(折算为标准状况)。下列有关结论不正确的是( )
| A.溶解的铁粉为2.8 g | B.原溶液中c(SO42-) ="0.5" mol/L |
| C.原混合液中c(H+ ) ="1.2" mol/L | D.原混合液中n(NO3-) ="0.08" mol |
M是一种新型可生物降解的高分子材料,主要制造可降解纤维、塑料和医用材料,其水解最终产物为N。燃烧9.0g的N只产生CO2和H2O,且质量分别为13.2g和5.4g,实验测得N在标准状况下的蒸气密度为4.02g/L;N的核磁共振氢谱显示的峰面积之比为1︰1︰1︰3。
(1)通过计算确定N的分子式。
(2)写出由N在催化剂条件下缩聚反应合成M的化学方程式。
(6分)把2.0mol/L CuSO4溶液和2.0mol/L H2SO4溶液等体积混合(假设混合后溶液的体积等于混合前两种溶液的体积之和)。计算:(不必写过程,直接将答案填写在答题卡上)
(1)混合溶液中H+、Cu2+、SO42-的物质的量浓度;
(2)向溶液中加入铁粉,足够长的时间后,铁粉有剩余,过滤,此时滤液中的Fe2+的物质的量浓度;
(3)取100mL该滤液,向其中加入适量硝酸,再加入足量氢氧化钠溶液,有红褐色沉淀生成。过滤,加热沉淀物至质量不再变化,得到红棕色的残渣。写出残渣的化学式,并计算残渣的质量(不计操作带来的损失)。
(7分)将标准状况下4.48 L的CO2通入适量的NaOH溶液中充分反应后,溶液中生成盐的质量为19.0 g。
(1)若要使生成的盐的质量变为25.2 g,则应继续向溶液中通入CO2多少克?(写出计算过程)
(2)向生成的19.0 g的盐溶液中加入一定量某物质,充分反应后,减压低温蒸发得到纯净的21.2 g Na2CO3固体。则:
①若只能加入0.05 mol某物质,则加入的物质可以是________或________。
②若只能加入0.10 mol某物质,则加入的物质可以是________或________。
将50.0g含有NH4NO3、(NH4)2SO4及其它难溶物的混合物样品,溶于水,过滤后加入足量浓NaOH溶液共热,在标准状况下收集到13.44 L氨气,再向溶液中加入足量BaCl2溶液,产生沉淀46.6g,试计算混合物中NH4NO3的物质的量及(NH4)2SO4的质量分数。
将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol/(L·min),且此时A的物质的量浓度为0.25mol·L-1。
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol/(L·min),且此时A的物质的量浓度为0.25mol·L-1。
求:(1)x的值是多少;
(2)B的平均反应速率;
(3)则反应开始前放入容器中A、B的物质的量。
(本题共14分)金属除了可以形成氧化物,氢化物之外,还能以碳化物、氮化物等形式存在,请根据题意完成下列计算:
57、某CaC2样品中含碳量为25%(杂质不含碳),该CaC2样品中CaC2的质量分数为 。
58、已知2Mg3N2+3CO2 → 3C+6MgO+2N2,10.0g Mg3N2与标准状况下4.48L CO2反应,固体质量增加 g。
第IIA族碳化物Be2C与CaC2组成的混合物与一定量的水反应,相关数据如下:
| 实验组号 |
① |
② |
③ |
④ |
| 碳化物(g) |
6.2 |
9.3 |
15.5 |
21.7 |
| 水(mL) |
18 |
18 |
18 |
18 |
| 气体(L,标准状况) |
3.36 |
5.04 |
8.4左右 |
8.4左右 |
59、求该混合物中Be2C与CaC2的物质的量之比 。
60、与18mL水恰好完全反应消耗该金属碳化物样品的质量是多少克?(保留一位小数)
(10分)某有机物的蒸气密度是相同状况下甲烷密度的3.625倍。把1.16g该有机物在氧气中充分燃烧,将生成的混合物依次通过足量浓硫酸和碱石灰,分别增重1.08g和2.64g,试求该有机物的分子式,要求有一定的答题步骤。
硝酸在有机合成、医药化工、化纤等行业应用非常广泛。工业上用氨催化氧化法可生产硝酸,其生产过程可表示为:
4NH3+5O2 4NO+6H2O ①
4NO+6H2O ①
4NO+3O2+2H2O→4HNO3 ②
完成下列计算:
(1)如果以一定量的氨气在一密闭容器中与足量氧气发生上述反应,冷却后所得溶液中溶质的质量分数是 (保留至1%)。
(2)某化肥厂以氨为原料通过题干中反应先产生硝酸,再利用氨气和硝酸反应制NH4NO3,已知由氨制 NO 的产率是 96%,NO 制硝酸的产率是 92%,氨被硝酸的吸收率为100%,则制备80吨 NH4NO3所需氨的体积(标准状况)为 m3(保留整数部分)。
一定质量的某金属 X和足量的稀H2SO4反应共有0.3mol电子发生转移,生成6.02×1022个
X和足量的稀H2SO4反应共有0.3mol电子发生转移,生成6.02×1022个  Xn+ ,这些阳离子共有1.3×6.02×1023个质子、1.4×6.02×1023个中子。
Xn+ ,这些阳离子共有1.3×6.02×1023个质子、1.4×6.02×1023个中子。
(1)求Z、n和A的值。(写过程)
(2)写出该金属与NaOH溶液反应的化学方程式。
氢气的生产、存储是氢能应用的核心。目前较成熟的生产、存储路线之一为:利用CH 3OH和H 2O在某Cu/Zn﹣Al催化剂存在下生产H 2,H 2与Mg在一定条件下制得储氢物质X。
回答问题:
(1)Al在周期表中的位置 。基态Zn的价层电子排布式 。
(2)水分子中氧原子的杂化轨道类型 。
(3)键能是衡量共价键稳定性的参数之一。 CH 3OH键参数中有 种键能数据。CH 3OH可以与水以任意比例互溶的原因是 。
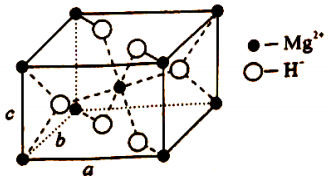
(4)X的晶胞结构如图所示(晶胞参数:α=β=γ=90°,a=b=450.25pm),密度为1.4g•cm ﹣ 3,H ﹣的配位数为 ,X的储氢质量分数是 ,c= pm (列出计算式即可)。
现有物质的量浓度为12.0mol/L的浓盐酸.
(1)配制100mL3.0mol/L的盐酸,需以上浓盐酸多少mL?
(2)假设浓盐酸的密度为1.2g/cm3,则其溶质的质量分数是多少?
已知羟基直接连在不饱和碳原子上的结构是不稳定的。A、B二种有机物互为同分异构体。已知A相对分子质量是58。1.16gA完全燃烧,将生成物通过浓硫酸,浓硫酸增重1.08g,再通过碱石灰,碱石灰增重2.64g。若A能发生银镜反应,B能使溴水褪色并且还能与钠反应生成氢气。
求:
(1)A的分子式
(2)写出A、B两种物质的结构简式。
将25.6g铜与足量的浓硫酸共热,完全反应后,试计算:
(1)生成的SO2在标准状况下的体积;
(2)被还原的硫酸的物质的量。