实验是研究化学的基础,下列有关实验的方法、装置或操作都正确的是( )

| A.用甲装置将海带灼烧成灰 |
| B.分离Na2CO3溶液和CH3COOC2H5,可使用如图乙所示实验装置 |
| C.利用丙装置进行石油分馏 |
| D.利用丁装置检验装置的气密性 |
分类法是学习和研究化学的一种常见的科学方法,以下分类合理的是( )
| A.根据酸分子中的氢原子个数将酸分为一元酸、二元酸、多元酸 |
| B.根据溶液导电能力的强弱将电解质分为强电解质和弱电解质 |
| C.盐酸、醋酸既是化合物又是酸 |
| D.甘油不是油、纯碱不是碱、干冰不是冰 |
下表中对应关系正确的是( )
| A |
CH3CH3+Cl2 CH3CH2Cl+HCl CH3CH2Cl+HClCH2=CH2+HCl→CH3CH2Cl |
均为取代反应 |
| B |
由油脂得到甘油,由淀粉得到葡萄糖 |
均发生了水解反应 |
| C |
Cl2+2Br-=2Cl-+Br2 Zn+Cu2+=Zn2++Cu |
均为单质被还原的置换反应 |
| D |
2Na2O2+2H2O=4NaOH+O2↑ Cl2+H2O=HCl+HClO |
均为水作还原剂的氧化还原反应 |
X、Y、Z三种元素的原子,其最外层电子排布分别为3s1、3s23p1和2s22p4,由这三种元素组成的化合物的化学式为( )
| A.X2YZ3 | B.XYZ2 | C.X2YZ2 | D.XYZ3 |
下列化学用语的书写正确的是( )
A.基态Mg原子的核外电子排布图: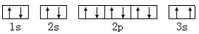 |
B.过氧化氢的电子式: |
| C.As原子的简化电子排布式:[Ar]4s24p3 |
D.羟基的电子式: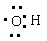 |
按电子排布,可以把周期表中的元素划分成几个区( )
| A.4个 | B.5个 | C.6个 | D.7个 |
25℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=2.6×10-9。该温度下,下列说法不正确的是
| A.同浓度的Na2SO4和Na2CO3混合溶液中滴加BaCl2溶液,BaSO4先析出 |
| B.BaCO3的悬浊液中加入少量的新制氯水,c(Ba2+)增大 |
C.BaSO4和BaCO3共存的悬浊液中,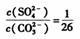 |
| D.BaSO4悬浊液中加入Na2CO3浓溶液,BaSO4不可能转化为BaCO3 |
已知25℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp(CaF2)=1.46×10-10。现向1L0.2mol·L-1HF溶液中加入1L0.2mol·L-1CaCl2溶液,则下列说法中,正确的是
| A.25℃时,0.1mol·L-1HF溶液中pH=1 |
| B.Ksp(CaF2)随温度和浓度的变化而变化 |
| C.加入CaCl2溶液后体系中的c(H+)浓度不变 |
| D.该体系中有CaF2沉淀产生 |
常温下,用0.01mol·L-1NaOH溶液滴定20.00mL0.01mol·L-1CH3COOH溶液,所得滴定曲线如右图。下列说法正确的是
| A.a点对应溶液的pH=2 |
| B.b点对应的溶液中:c(OH-)+c(CH3COO-)=c(Na+)+c(H+) |
| C.c点表示NaOH溶液与CH3COOH溶液恰好完全反应 |
| D.d点对应的溶液中,水的电离程度小于同温下纯水的电离程度 |
黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:
S(s)+2KNO3(s)+3C(s)==K2S(s)+N2(g)+3CO2(g)ΔH=xkJ·mol-1
已知碳的燃烧热ΔH1=akJ·mol-1
S(s)+2K(s)==K2S(s)ΔH2=bkJ·mol‾1
2K(s)+N2(g)+3O2(g)==2KNO3(s)ΔH3=ckJ·mol‾1,则x为
| A.3a+b-c | B.c+3a-b | C.a+b-c | D.c+a-b |
25℃下,0.1mol/L的Na2S溶液,下列叙述正确的是
| A.升高温度,溶液的pH降低 |
| B.加入NaOH固体,溶液中的c(Na+)、c(S2-﹣)均增大 |
| C.c(Na+)>c(OH﹣)>c(S2-﹣)>c(H+) |
| D.2c(Na+)=c(S2-﹣)+c(HS﹣)+c(H2S) |
现有体积相同、pH均为2的盐酸和醋酸,下列叙述错误的是
| A.盐酸溶液中的c(Cl-)与醋酸溶液中的c(CH3COO-)相等 |
| B.它们与NaOH完全中和时,醋酸溶液所消耗的NaOH多 |
| C.分别用水稀释相同倍数时,n(Cl-)<n(CH3COO-) |
| D.它们分别与足量CaCO3反应时,放出的CO2一样多 |
水解原理在工农业生产、日常生活中具有重要用途。下列关于物质的用途,与盐类水解有关的是
| A.次氯酸钠常用作消毒剂 | B.FeCl3用于印刷线路板 |
| C.热的纯碱溶液用于清洗油污 | D.氯化钠是氯碱工业的重要原料 |