碘是人体必须的元素之一,海洋植物如海带、海藻中含有丰富的、以碘离子形式存在的碘元素。在实验室中,从海藻里提取碘的流程和实验装置如下:
(1)指出上述提取碘的过程中有关实验操作的名称:步骤③________,步骤⑤_______。
(2)写出步骤④对应反应的离子方程式:___________ __。
(3)提取碘的过程中,可供选择的有机试剂是_______________。
| A.酒精 | B.醋酸 | C.四氯化碳 | D.苯 |
(4)为了使海藻灰中的碘离子转化为碘的有机溶液,即完成步骤③至⑤,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网、以及必要的夹持仪器和物品,尚缺少的玻璃仪器是_________。
(5)从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏。指出下图实验装置中存在的错误之处: 。
工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质.某同学设计了如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解).
(1)实验原理
①Al4C3与硫酸反应可生成CH4,
②AlN溶于强酸产生铵盐,溶于强碱生成氨气,请写出AlN与过量NaOH溶液反应的化学方程式 ,
(2)实验装置(如图所示)

(3)实验过程
①连接实验装置,检验装置的气密性.称得D装置的质量为yg,滴定管的读数为amL.
②称取xg AlN样品置于装置B瓶中;塞好胶塞,关闭活塞 ,打开活塞 ,通过分液漏斗加入稀硫酸,与装置B瓶内物质充分反应.
③待反应进行完全后,关闭活塞 ,打开活塞 ,通过分液漏斗加入过量 (填化学式),与装置B瓶内物质充分反应.
④ (填入该步应进行的操作).
⑤记录滴定管的读数为bmL,称得D装置的质量为zg.
(4)数据分析(已知:该实验条件下的气体摩尔体积为Vm L•mol﹣1)
①Al4C3的质量分数为 .
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积 (填“偏大”、“偏小”或“无影响”).
③AlN的质量分数为 。
乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4·xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。
该组同学的研究课题是:探究测定草酸晶体(H2C2O4·xH2O)中的x值。通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定。学习小组的同学设计了滴定的方法测定x值。
①称取2.520 g纯草酸晶体,将其制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4。
③用浓度为0.100 0 mol·L-1的KMnO4标准溶液进行滴定,达到终点时消耗20.00 mL。
(1)写出草酸(H2C2O4)与酸性高锰酸钾溶液反应的化学方程式____________。
(2)滴定时,将酸性KMnO4标准液装在如图中的________(填“甲”或“乙”)滴定管中。
(3)本实验滴定达到终点的标志是__________。
(4)通过上述数据,求得x=________。
讨论:①若滴定终点时仰视滴定管刻度,则由此测得的x值会_______(填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x值会________。
索氏制碱又称氨碱法,其主要生产流程如右图:
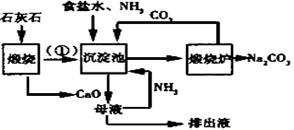
36.用化学方程式表示沉淀池中发生的反应 ,排出液的主要成分是 。
氨碱法制得的纯碱样品中可能会含有杂质(如NaCl)。现用两个实验方案测定纯碱样品的纯度。
方案1气体法 :称取样品m克装入Y型试管左侧(如右图)
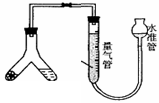
37.Y型试管另一端应装入试剂为 ,量气管中液体应为 。若最后读数时,发现水准管液面高于量气管(其他操作都正确),则计算所得纯碱样品的纯度值 (填“偏大”、“偏小”或“无影响”)。
方案2滴定法:
已知: 25℃时0.1 mol/L的NaHCO3溶液的pH约为8.3
0.1mol/L的Na2CO3 溶液的pH约为11.6
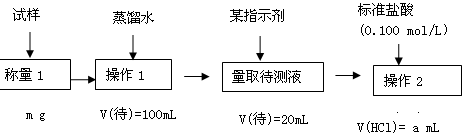
38.指示剂选用酚酞,则该纯碱样品的纯度为 。(请用所给数据的字母符号表示)
氨碱法中钠利用率不高,一些化工专家开始研究有机胺制碱法,其工艺流程如下:
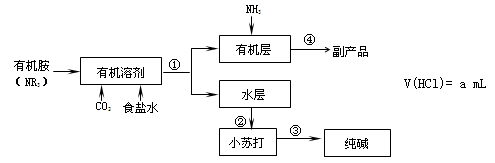
已知: NR3+ HCl →NR3·HCl,且NR3·HCl易溶于有机溶剂
NR3·HCl+NH3→NR3 +NH4Cl
39.有机胺制碱法反应生成小苏打的化学方程式是 , 操作①是 。
40.副产品的成分是 ,本工艺流程中可循环利用的物质是 。
请回答实验室分馏石油的有关问题:
(1)实验室分馏石油的正确操作顺序是
E→ → →A→ → →G。
| A.连接接液管 |
| B.装入碎瓷片和石油,塞上带温度计的塞子 |
| C.检查装置气密性 |
| D.连接冷凝管及进出水管 |
E.在铁架台上放酒精灯,固定好铁圈,放上石棉网
F.固定好蒸馏烧瓶
G.加热
(2)以下是石油分馏的装置图,试指出有关仪器的名称:
A ;B 。
(3)图中有 处错误,
(4)分馏石油得到的各个馏分都是 (填“混合物”或“纯净物”)。
ClO2是一种国际上公认的安全无毒的绿色水处理剂。回答下列问题:
(1)工业废水的处理:
某实验兴趣小组通过右图装置制备ClO2,并用它来处理Wg某T业废水(含Mn2+、CN-等)。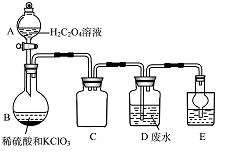
已知:i.ClO2为黄绿色气体,极易溶于水,沸点11℃;
ii.ClO2易爆炸,若用“惰性气体”等稀释时,爆炸性则大大降低;
iii.某T业废水处理过程中Mn2+转化为MnO2、CN-转化为对大气无污染的气体;
iv.装置B中发生的反应为:H2C2O4+H2SO4+2KClO3=K2SO4+2CO2++2C1O2+H2O.
①A装置的名称是 ,C装置的作用为 。
②用H2C2O4溶液、稀硫酸和KC1O3制备ClO2的最大优点是 。
③写出装置D中除去Mn2+的离子方程式 。
④E装置中盛放的试剂可选用 (填标号)。
a.CCl4 b.H2O c.稀盐酸 d.NaOH溶液
(2)废水中CN-含量的测定:
另取工业废水W g于锥形瓶中,加入10 mL0.10 mol/L的硫酸溶液,用0.020 0 mol/L的KMnO4标准溶液进行滴定,当达到终点时共消耗KMnO4标准溶液25. 00 mL。在此过程中:
①使用棕色滴定管的原因是 ,滴定终点的判断依据是________________。
②W g 工业废水中CN-的含量为 mol。
③若滴定管在盛放标准溶液前未用标准液润洗,则测定结果将 (填“偏高”、“偏低” 或“无影响”)。
现有一块铁碳合金,某化学兴趣小组为了测定合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置进行实验(夹持仪器已省略),请你参与此项活动并回答相应的问题。

(1)以下有关合金的说法,正确的是 (填写字母)
A.铁碳合金的熔点高于纯铁和碳
B.铁碳合金的熔点介于纯铁和碳之间
C.铁碳合金的硬度大于纯铁
D.其他条件相同时,铁碳合金的耐腐蚀性强于纯铁
(2)按图示连接好装置,检验气密性,加入药品,称量F的质量,将m g合金样品放入A中,再通过B加入过量的浓硫酸。未点燃酒精灯前,A中无明显现象,其原因是: 。
(3)点燃酒精灯,反应一段时间后,C、D中可观察到明显的现象。写出合金样品在A中反应的化学方程式_______ , _________。
(4)C中的现象是____________________,D中足量酸性KMnO4溶液的作用是 。
某氯化铁与氯化亚铁的混合物。现要测定其中铁元素的质量分数,实验按以下步骤进行: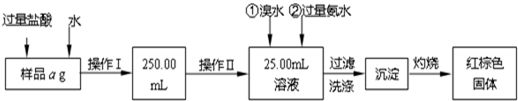
Ⅰ.请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有________、________,(填仪器名称)。
(2)请写出加入溴水发生的离子反应方程式__________________。
(3)将沉淀物加热,冷却至室温,用天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2=0.3g,则接下来还应进行的操作是____________;若蒸发皿质量是w1 g,蒸发皿与加热后固体总质量是w2 g,则样品中铁元素的质量分数是_____。
Ⅱ.有同学提出,还可以采用以下方法来测定:
(1)溶解样品改用了硫酸,而不在用盐酸,为什么?
__________________________。
(2)选择的还原剂是否能用铁__________(填“是”或“否”),原因是:__________。
(3)若滴定用掉c mol/L KMnO4溶液b mL,则样品中铁元素的质量分数是____________。
为测定已变质的过氧化钠的纯度,设计如下图所示的实验;Q为一具有良好的弹性气球,称取一定量的样品放于其中,按图安装的实验装置打开分液漏斗的活塞,将稀H2SO4滴入气球中。请填空: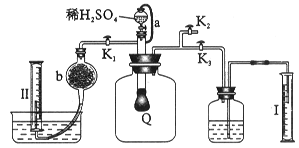
(1)Q内发生反应生成_________种气体,其中的反应有_________个氧化还原反应。
(2)为测定反应生成气体的总体积,滴稀H2SO4前必须关闭(填K1、K2或K3,下同)_________,打开_________。
(3)当上述反应停止,将K1、K2、K3处于关闭状态,然后先打开K2,再缓缓打开K1,这时可观察到的现象是_________。
(4)导管a的作用是_________。
(5)b中装的固体试剂是_________,为何要缓缓打开K1_________。
(6)实验结束时量筒I中有x mL水,量筒II中收集到y mL气体,则过氧化钠的纯度是_________(体积折算到标准状况)。
海藻中含有丰富的碘元素(以I-形式存在)。实验室中提取碘的流程如下:
(1)实验操作③的名称是__________,所用主要仪器名称为__________。
(2)提取碘的过程中,可供选择的有机试剂是__________(填序号)。
A.酒精(沸点78℃) B.四氯化碳(沸点77℃)
C.甘油(沸点290℃) D.苯(沸点80℃)
(3)在操作②中,溶液中生成少量ICl,为消除此杂质,使碘全部游离出来,应加入适量(填序号)_____溶液,反应的离子方程式为 。
A.KIO3 B.HClO C.KI D.Br2
(4)为使从含碘有机溶液中提取碘并回收溶剂顺利进行,采用水浴加热蒸馏(如图所示)。请指出图中实验装置中错误之处(有几处填几处,下列空白可不填满,也可补充)。
①_________________________,
②_________________________,
③_________________________,
④_________________________。
(5)实验中使用水浴的原因是 ,最后晶体碘聚集在__________(填仪器名称)中。
目前,回收溴单质的方法主要有水蒸气蒸馏法和萃取法等。某兴趣小组通过查阅相关资料拟采用如下方案从富马酸废液(含溴0.27%)中回收易挥发的Br2:

(1)操作X所需要的主要玻璃仪器为 ;反萃取时加入20%的NaOH溶液,其离子方程式为 。
(2)反萃取所得水相酸化时,需缓慢加入浓硫酸,并采用冰水浴冷却的原因是: 。
(3)溴的传统生产流程为先采用氯气氧化,再用空气水蒸气将Br2吹出。与传统工艺相比,萃取法的优点是 。
(4)我国废水三级排放标准规定:废水中苯酚的含量不得超过1.00mg/L。实验室可用一定浓度的溴水测定某废水中苯酚的含量,其原理如下:

①请完成相应的实验步骤:
步骤1:准确量取25.00mL待测废水于250mL锥形瓶中。
步骤2:将4.5 mL 0.02mol/L溴水迅速加入到锥形瓶中,塞紧瓶塞,振荡。
步骤3:打开瓶塞,向锥形瓶中加入过量的0.1mol/L KI溶液,振荡。
步骤4: ,再用0.01 mol/L Na2S2O3标准溶液滴定至终点,消耗 Na2S2O3溶液15 mL。(反应原理:I2 + 2Na2S2O3 =" 2NaI" + Na2S4O6)
步骤5:将实验步骤1~4重复2次。
②该废水中苯酚的含量为 mg/L。
③步骤3若持续时间较长,则测得的废水中苯酚的含量 。(填“偏高”、“偏低”或“无影响”)。
(共18分)(1)实验室里需用480ml 0.2mol/L的硫酸铜溶液,若以胆矾(化学式为CuSO4·5H2O)为原料进行配制,请回答下列问题:
(i)完成下列步骤:
①用托盘天平称取胆矾 g。
②将称好的胆矾放入 中,加适量蒸馏水将其溶解,待 后将溶液沿玻璃棒转移入X容器中,X容器应为 。
③用少量蒸馏水洗涤溶解仪器2~3次,将洗涤液也注入X容器中,在操作过程中不能损失点滴液体,否则会使溶液的浓度 (偏高或偏低)。
④向X容器内加水至刻度线下 时,改用 小心地加水至液面与刻度线相切。若加水时仰视刻度线,会造成溶液浓度 (偏高或偏低)。
⑤最后盖好瓶塞,反复上下颠倒, 。
(ii)在X容器的使用方法中,下列操作不正确的是____________
A.X容器使用前需检验是否漏水
B.X容器用水洗净后,烘干后方可使用
C.若X容器洗净后未经干燥就直接使用,对溶液浓度无影响。
D.配制溶液时,把称好的固体用纸条小心倒入X容器中,加水溶解时需用玻璃棒引流。
(2)化学中很多时候需要对混合物进行分离和提纯,以下这套装置就常常用来分离液态混合物。
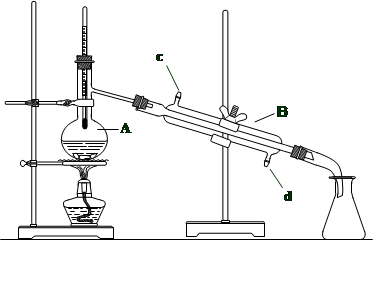
①利用这套装置来分离液态混合物的方法叫 。
②写出有关仪器的名称:A. B.
③图中有一处明显错误,请写出正确的做法: ,仪器B中的冷却水应该从 口(c或d)通入。
I、如图为实验室蒸馏自来水得到少量蒸馏水的装置示意图,请根据图示回答下列问题:

(1)装置中仪器A的名称是 。
(2)请指出上图中的两处明显错误: 、 。
(3)实验时A中除加入少量自来水外,还需加入少量的沸石,其作用是 。
II、选择下列实验方法分离物质,将分离方法的序号填在横线上。
A 萃取分液 B 升华 C 结晶 D 分液 E 蒸馏 F 过滤
(1) 分离饱和食盐水与沙子的混合物;
(2) 从硝酸钾和氯化钠的混合液中获得硝酸钾;
(3) 分离水和汽油的混合物;
(4) 分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物。
某化学兴趣小组设计如下流程,从酸性工业废液(含H+、Al3+、Mg2+、Cr3+、SO42-)中提取铬。

有关数据如下表:
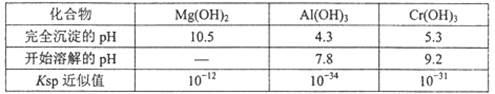
回答下列问题:
(1)步骤①所得滤液可用于制取MgSO4·7H2O,酸性工业废液中加入适量氧化铝的作用是 。
(2)若酸性废液中c(Mg2+)=0.lmol.L-l, 为达到步骤①的实验目的,则废液的pH应保持在 范围(保留小数点后l位)。
(3)步骤②中生成NaCrO2的离子方程式为 。
(4)步骤④中反应的离子方程式为 。
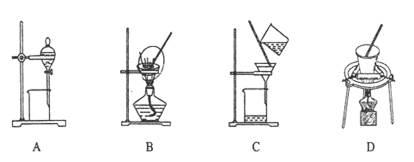
(5)步骤⑤在空气中充分灼烧的目的是 ,可选用的装置是 (填序号)。
(6)用如图所示装置制取铬酸钠(Na2CrO4),回答相关问题。
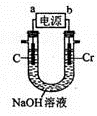
①a是电源的____极,阳极的电极反应式为________。
②若电解一段时间后阴极收集到标准状况下的气体3.36 L,则理论上可制得 g铬酸钠(忽略反应2CrO42-(aq) + 2H+(aq) Cr2O72-(aq)+ H2O(1)的影响)
Cr2O72-(aq)+ H2O(1)的影响)
某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成橙黄色晶体X。为确定其组成,进行如下实验。
(1)氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mLc1 mol/L的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol/L NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mLNaOH溶液。
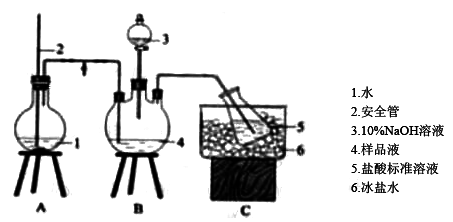
氨的测定装置(已省略加热和夹持装置)
①装置中安全管2的作用是 。盛10%NaOH溶液仪器3的名称是 。
②用NaOH标准溶液滴定过剩的HCl时,应使用 式滴定管,用酚酞做指示剂,判断达到滴定终点时的现象为 。
③样品中氨的质量分数表达式为 。测定氨前应该对装置进行气密性检验,若气密性不好测定结果将 (填“偏高”或“偏低”)。
(2)氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色)。滴定终点时,若溶液中c(Ag+)=2.0×10-5 mol/L,则c(CrO42-)为 mol/L,(已知:Ksp(Ag2CrO4)=1.12×10-12)
(3)经测定,样品X中钴、氨和氯的物质的量比为1:6:3,又知X 的化学式类似于氢氧化二氨合银Ag(NH3)2OH,制备X的化学方程式为 。X的制备过程中温度不能过高的原因是 。