钒是一种重要的合金元素,还用于催化剂和新型电池。从含钒固体废弃物(含有SiO2、Al2O3及其他残渣)中提取钒的一种新工艺主要流程如下: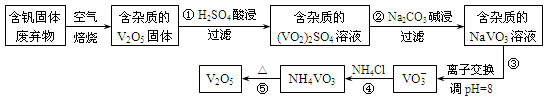
部分含钒化合物在水中的溶解性如下表:
| 物质 |
V2O5 |
NH4VO3 |
VOSO4 |
(VO2)2SO4 |
| 溶解性 |
难溶 |
难溶 |
可溶 |
易溶 |
部分含钒化合物在水中的溶解性如下表:
请回答下列问题:
(1)反应①所得溶液中除H+之外的阳离子有___________。
(2)反应②碱浸后滤出的固体主要成分是 (写化学式)。
(3)反应④的离子方程式为 。
(4)25℃、101 kPa时,4Al(s)+3O2(g)==2Al2O3(s) ΔH1=-a kJ/mol
4V(s)+5O2(g)==2V2O5(s) ΔH2=-b kJ/mol
用V2O5发生铝热反应冶炼金属钒的热化学方程式是 。
(5)钒液流电池(如图所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过。电池放电时负极的电极反应式为 ,电池充电时阳极的电极反应式是 。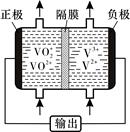
(6)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应①后溶液中的含钒量,反应的离子方程式为:2VO2++H2C2O4+2H+===2VO2++2CO2↑+2H2O。取25.00 mL 0.1000 mol/L H2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0 mL,由此可知,该(VO2)2SO4溶液中钒的含量为 g/L。
硅在地壳中的含量较高。硅及其化合物的开发由来已久,在现代生活中有广泛应用。回答下列问题:
(1)1810年瑞典化学家贝采利乌斯在加热石英砂、木炭和铁时,得到一种“金属”。这种“金属”可能是 。
(2)陶瓷、水泥和玻璃是常用的硅酸盐材料。其中生产普通玻璃的主要原料有 。
(3)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下: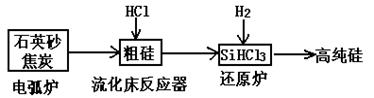
| |
发生的主要反应 |
| 电弧炉 |
SiO2+2C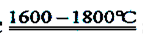 Si+2CO↑ Si+2CO↑ |
| 流化床反应器 |
Si+3HCl SiHCl3+H2 SiHCl3+H2 |
| 还原炉 |
SiHCl3+H2 Si+3HCl Si+3HCl |
①用石英砂和焦炭在电弧炉中高温加热也可以生产碳化硅,该反应的化学方程式为 ;碳化硅又称 ,其晶体结构与 相似。
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和 。
| 物质 |
Si |
SiCl4 |
SiHCl3 |
SiH2Cl2 |
SiH3Cl |
HCl |
SiH4 |
| 沸点/℃ |
2355 |
57.6 |
31.8 |
8.2 |
-30.4 |
-84.9 |
-111.9 |
③SiHCl3极易水解,其完全水解的产物为 。
(4)氯碱工业可为上述工艺生产提供部分原料,这些原料是 。
根据Fe3++ Ag  Fe2+ + Ag+ ,可用Fe3+的盐溶液做刻蚀液将试管中的银镜洗去。
Fe2+ + Ag+ ,可用Fe3+的盐溶液做刻蚀液将试管中的银镜洗去。
(1)FeCl3溶液显酸性,原因是 (用离子方程式表示)。
(2)关于FeCl3溶液洗银后的相关叙述正确的是 (填序号)。
a.c(Fe3+)减小 b.c(Cl-)不变 c.铁元素质量减小
(3)Fe(NO3)3溶液洗银时,甲同学认为NO3-也能将银氧化。他认为可以通过检验Fe(NO3)3溶液洗银后NO3-的还原产物来判断NO3-是否能将银氧化,而乙同学认为此方法不 可行,乙同学的理由是 。
(4)乙同学欲从洗银废液(Fe3+、 Fe2+、 Ag+、 NO3-)中回收银和刻蚀液,设计了如下路线:
①过程Ⅰ中反应的离子方程式是 。
②过程Ⅱ中加入的试剂可以是 。
(5)镀银后的银氨溶液放置时会析出有强爆炸性的物质,所以不能贮存。从银氨溶液中回收银的方法是:向银氨溶液中加入过量盐酸,过滤,向沉淀AgCl中加入羟氨(NH2OH),充分反应后可得银,羟氨被氧化为N2。
①生成AgCl沉淀的化学方程式是 。
②若该反应中消耗3.3 g羟氨,理论上可得银的质量为 g。
海水中含有丰富的镁资源。工业上常用海水晒盐后的苦卤水提取Mg,流程如下图所示: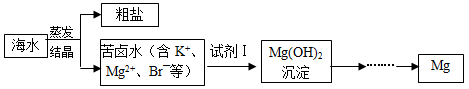
(1)试剂Ⅰ一般选用_________(填化学式)。
(2)工业制取镁的化学方程式为_____________________________________。
(3)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。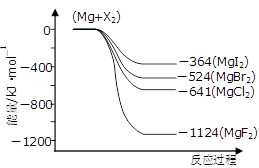
①由图可知Mg与卤素单质的反应均为_________(填“放热”或“吸热”)反应;推测化合物的热稳定性顺序为MgI2 ______MgF2(填“>”、“=”或“<”)。
②依上图数据写出MgBr2(s)与Cl2(g)反应的热化学方程式_________________________。
(4)金属Mg与CH3Cl在一定条件下反应可生成CH3MgCl,CH3MgCl是一种重要的有机合成试剂,易与水发生水解反应并有无色无味气体生成。写出CH3MgCl水解的化学方程式______________。
(5)向Mg(OH)2中加入NH4Cl溶液,可使沉淀溶解,请结合平衡原理和必要的文字解释原因_________。
氯化亚铜(CuCl)是一种白色固体,微溶于水,不溶于酒精。研究该物质的应用新领域、生产新方法及生产过程中的环保新措施都具有重要意义。
(1)镁—氯化亚铜海水电池,可用于鱼雷上。该电池被海水激活时,正极导电能力增强,同时产生气泡,则正极上被还原的物质有 、 (填化学式)。
(2)工业上以铜作催化剂,氯代甲烷和硅粉反应合成甲基氯硅烷的过程中产生大量废渣(主要成分为硅粉、铜、碳等)。某课外小组以该废渣为原料制CuCl,流程示意图如下:
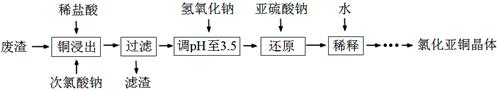
回答下列问题:
①氯代甲烷有4种,其中属于重要工业溶剂的是 (写出化学式)。
②“还原”阶段,SO32-将Cu2+还原得[CuCl2]-,完成下列离子方程式。
 Cu2++
Cu2++ Cl-+
Cl-+ SO32-+
SO32-+ =
= [CuCl2]-+
[CuCl2]-+ +
+
③在稀释过程中存在下列两个平衡:
ⅰ.[CuCl2]- CuCl+Cl- K=2.32
CuCl+Cl- K=2.32
ⅱ.CuCl(s) Cu+(aq)+Cl- Ksp=1.2×10-6
Cu+(aq)+Cl- Ksp=1.2×10-6
当[CuCl2]-完成转化时(c([CuCl2]-)≤1.0×10-5 mol·L-1),溶液中c(Cu+)≥ 。
④获得CuCl晶体需经过滤、洗涤、干燥。洗涤时,常用无水乙醇代替蒸馏水做洗涤剂的优点是 (写一点)。
(3)工业生产CuCl过程中产生浓度为2~3 g·L-1的含铜废水,对人及环境都有较大的危害,必须进行回收利用。用萃取法富集废水中的铜,过程如下:

①实验室完成步骤ⅰ时,依次在分液漏斗中加入曝气后的废水和有机萃取剂,经振荡并 后,置于铁架台的铁圈上静置片刻,分层。分离上下层液体时,应先 ,然后打开活塞放出下层液体,上层液体从上口倒出。
②写出步骤ⅱ的离子方程式: 。
CuSO4溶液与K2C2O4溶液混合反应,产物之一是只含一种阴离子的蓝色钾盐水合物。通过下述实验确定该晶体的组成。
步骤a:称取0.672 0 g样品,放入锥形瓶,加入适量2 mol·L-1稀硫酸,微热使样品溶解。再加入30 mL水加热,用0.200 0 mol·L-1 KMnO4溶液滴定至终点,消耗8.00 mL。
步骤b:接着将溶液充分加热,使淡紫红色消失,溶液最终呈现蓝色。冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI。用0.250 0 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗8.00 mL。
已知涉及的部分离子方程式如下:
步骤a:2 MnO4-+5C2O42-+16H+= 2Mn2++8H2O+10CO2↑
步骤b:2Cu2++4I-= 2CuI↓+I2 I2+2S2O32-= 2I-+S4O62-
(1)已知室温下CuI的Ksp=1.27×10-12,欲使溶液中c(Cu+)≤1.0×10-6 mol·L-1,应保持溶液中
c(I-)≥ mol·L-1。
(2)MnO4-在酸性条件下,加热能分解为O2;同时生成Mn2+。该反应的离子方程式为 ;若无该操作,则测定的Cu2+的含量将会 (填“偏高”、“偏低”或“不变”)。
(3)步骤b用淀粉溶液作指示剂,则滴定终点观察到的现象为 。
(4)通过计算确定样品晶体的组成。
明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al 、 Al2O3及少量SiO2和FeO ·xFe2O3)可制备明矾。工艺流程如下: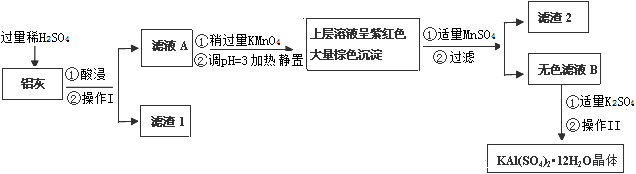
回答下列问题:
(1)明矾净水的原理是(用离子方程表示)
(2)操作Ⅰ是 ,操作Ⅱ是蒸发浓缩、 、过滤、 、干燥。
(3)检验滤液A中是否存在Fe2+的试剂是 (只用一种试剂)
(4)在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下Fe2+转化为Fe3+,MnO4- 转化为Mn2+) 。
已知:生成氢氧化物沉淀的pH如下表所示
| |
Al(OH)3 |
Fe(OH)2 |
Fe(OH)3 |
| 开始沉淀时 |
3.4 |
6.3 |
1.5 |
| 完全沉淀时 |
4.7 |
8.3 |
2.8 |
注:金属离子的起始浓度为0.1 mol·L-1
根据表中数据解释调pH=3的目的 。
(5)己知:在pH=3、加热条件下,MnO4- 可与Mn2+反应生成MnO2。
加入MnSO4发生反应的离子方程式为: 。滤渣2含有的物质
是 。
【改编】(18分)NOx、SO2是主要的大气污染物,科学处理这些污染物对改善人们的生存环境具有重要的现实意义。
(1)利用甲烷催化还原氮氧化物。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ•mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=-867kJ•mol-1
则CH4与NO反应生成N2与CO2的热化学方程式为:______________________________________。
(2)利用氧化氮氧化物的流程如下: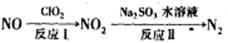
写出反应Ⅱ的化学方程式 ___________________;已知反应I的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,若反应Ⅱ中生成N2的体积(标准状况下)为2.24L,则反应I中转移电子的物质的量为_________,还原剂的质量为_________。
(3)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水电离出的OH‾浓度_________(填“增大”、“减小”或“不变”);试计算溶液中 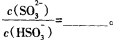 。
。
(常温下H2SO3的电离常数: )
)
(4)利用Fe2(SO4)3溶液也可处理SO2废气,其流程如下图所示。
①简述用Fe2(SO4)3晶体配制溶液A的方法__________________。
②写出向溶液A中通入含SO2废气反应的离子方程式______________________________。
③设计实验验证溶液B是否仍具有处理废气的能力,简述实验的操作、现象和结论_______________。
某校化学小组的同学将一批废弃的线路板简单处理后,得到Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计了如下制备强酸铜和硫酸铝晶体的方案:
回答下列问题:
(1)第②步加入H2O2是为了除云Fe2+,该反应的离子方程式为_________;
(2)滤渣2的主要成分是Fe(OH)3和Al(OH)3。由滤渣2制取Al2(SO4)3·18H2O实验过程的最后步骤是__________________。
(3)用第③步所得CuSO4·5H2O可制得Cu(OH)2。化学活动小组为探究Cu(OH)2受热分解产物及产物性质,设计如下实验过程:取0.98g Cu(OH)2固体加热,有铜的氧化物生成,其质量随温度变化如图所示,产物A、B的化学式分别为____和Cu2O。通过以上实验和图像可以得出如下结论:高温时B______(填“较稳定”或“不稳定”)。
活动小组同学还进行了如下实验:
①甲同学用下列装置进行实验(夹持装置末画出),最终得出的结论是加热时A可将NH3氧化为N2,A被还原为单质Cu,支持甲同学结论的现象是______;
②乙同学用下列实验装置进行实验,实验中观察到混合粉末最终变成红色物质,同时生成一种无色、有刺激性气味的气体,该气体化学式为_______;有人认为乙同学的实验装置中在装B物质的试管与烧杯之间需加一个防倒吸装置,你认为是否有必要_____,若有必要请简述原因并加以改进____________。
(1 6分)钒是一种重要的合金元素,还用于催化剂和新型电池。从含钒固体废弃物(含有SiO2、
Al2O3及其他残渣)中提取钒的一种新工艺主要流程如下: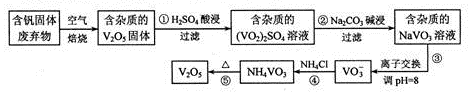
部分含钒化合物在水中的溶解性如下表:
请回答下列问题:
(1)反应①所得溶液中除H+之外的阳离子有
(2)反应②碱浸后滤出的固体主要成分是 (写化学式)。
(3)反应④的离子方程式为
(4)250C、101 kPa时,
用V2O5发生铝热反应冶炼金属钒的热化学方程式是 。
(5)钒液流电池(如图所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过。电池放电时负极的电极反应式为 ,电池充电时阳极的电极反应式是 。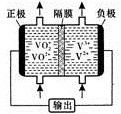
(6)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应①后溶液中的含钒量,反应的离子方程式为:2 VO2++ H2C2O4+2 H+="2" VO2++2CO2↑+2H2O,取25.00 mL 0.1000 mol/L H2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0 mL,由此可知,该(V02)2S04溶液中钒的含量为 g/L。
按要求完成下列问题:
(1)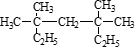 系统命名法为____________________ ,
系统命名法为____________________ ,
(2)4―甲基―1―戊烯的键线式为 __________________________ ,
(3)写出乙醛与新制氢氧化铜反应化学方程式 ____________________________________,
(4)下列有关实验的说法不正确的是_____________。
| A.制乙烯时,温度计应插入反应混合液中 |
| B.检验C2H5Cl中氯元素时,将C2H5Cl和NaOH水溶液混合加热,然后用稀硫酸酸化,再加入AgNO3溶液 |
| C.做过银镜反应的试管用氨水洗涤,做过苯酚的试管用酒精洗涤 |
| D.将一定量CuSO4和NaOH溶液混合后加入甲醛溶液,加热未产生砖红色沉淀,原因可能是NaOH量太少 |
(本题共12分)碘及其化合物可广泛用于医药和工业生产等。回答下列问题:实验室用海带提取I2时操作步骤依次为:灼烧、溶解、过滤、_______、_______及蒸馏。
灼烧海带时除需要三脚架、酒精灯、玻璃棒外,还需要的实验仪器是______________。
“过滤”后溶液中含一定量硫酸盐和碳酸盐。现要检验溶液中的I-,需选择的试剂组合及其先后顺序是_____________。(选填编号)
a.AgNO3溶液 b.Ba(NO3)2溶液 c.BaCl2溶液 d.CaCl2溶液在海带灰滤液中加入适量氯水后一定存在I2,可能存在IO3—。
请补充完整检验含I2溶液中是否含有IO3—的实验方案(可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液):
①取适量含I2溶液用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在;
②_____________________________________________________________________。分解水可用SO2/I2循环法。该法共涉及三步化学反应。
___________________;2H2SO4  2SO2↑+ O2↑+ 2H2O;____________________。
2SO2↑+ O2↑+ 2H2O;____________________。
与传统的分解水的方法相比,本法的优点是____________;缺点是_____________。
某工业废玻璃粉末含SiO2、Fe2O3、CeO2、FeO等。某课题小组设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵矾。
已知:CeO2不溶于稀硫酸;酸性条件下,Ce3+易水解,Ce4+有较强氧化性。
(1)硫酸铁铵矾可净水,其原理是(写离子方程式) 。
(2)滤液A的主要成分 (填写化学式)。
(3)反应①的离子方程式是 。
(4)反应②的化学反应方程式是 。
(5)已知制硫酸铁铵矾晶体[Fe2(SO4) 3·(NH4) 2SO4·24H2O,式量964]的产率为80%,若加入13.2g (NH4) 2SO4(式量132),可制得晶体的质量是 。
(6)化合物HT可作为萃取剂能将铈离子从水溶液中萃取出来,过程表示为:
Ce2(SO4)3 (水层)+ 6HT(有机层) 2CeT3 (有机层)+3H2SO4(水层)
2CeT3 (有机层)+3H2SO4(水层)
分液得到CeT3 (有机层),再加入H2SO4 获得较纯的含Ce3+的水溶液。可选择硫酸作反萃取剂的原因是 (从平衡移动角度回答)。
(9分)
实验室制备1,2-二溴乙烷的反应原理如下:

可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。
用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如下图所示:

有关数据列表如下:
| 乙醇 |
1,2-二溴乙烷 |
乙醚 |
|
| 状态 |
色液体 |
无色液体 |
无色液体 |
| 密度/ |
0.79 |
2.2 |
0.71 |
| 沸点/℃ |
78.5 |
132 |
34.6 |
| 熔点/℃ |
一l30 |
9 |
-1l6 |
回答下列问题:
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置中应加入,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制各反应已经结束的最简单方法是;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在层(填"上"、"下");
(5)若产物中有少量未反应的,最好用洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是;但又不能过度冷却(如用冰水),其原因是。
Ⅰ.羰基硫(COS)可作为一种熏蒸剂,能防止某些昆虫的危害,其分子结构和CO2相似。
(1)羰基硫(COS)的电子式为:______________。
(2)羰基硫(COS)用氢氧化钠溶液处理及利用的过程如下:
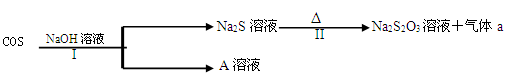
已知A是一种正盐,则A的化学式为______________;若气体a为单质,
反应II的离子方程式为________________________________________________。
Ⅱ.海水中含有丰富的镁资源。锂(Li)与镁元素性质相似。
(1)物质的量为0.10 mol的锂在只含有N2和O2混合气体的容器中燃烧,反应后容器内固体物质的质量m克,m的取值范围是 ;
(2)锂电池是新一代高能电池,目前已研究成功多种锂电池。某离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示。电池反应为LiCoO2+C6 CoO2+LiC6,则放电时电池的正极反应为 。
CoO2+LiC6,则放电时电池的正极反应为 。
(3)为了回收废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量Al、Fe等)可通过下列实验方法回收钴、锂。
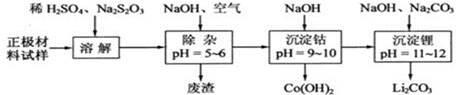
①在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过程中的化学反应方程式为 。
②调整pH=5-6的目的是 。