高铁酸盐是一种强氧化剂,在能源、环保等方面均有广泛的用途。湿法、干法制备高铁酸钾的原理如表所示:
| 湿法 |
强碱介质中,Fe(NO3)3与NaClO反应得到紫红色高铁酸盐溶液 |
| 干法 |
Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾(K2FeO4)和KNO2等产物 |
(1)某工厂用湿法制备高铁酸钾的流程如图所示: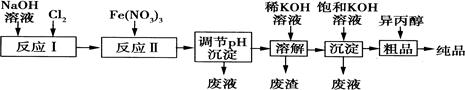
①反应I的化学方程式为 。
②反应Ⅱ的离子方程式为 。
③已知25℃时Fe(OH)3的Ksp=4.0×10—38,反应Ⅱ后的溶液中c(Fe3+)=4.0×10—5mol·L—1.则需调整pH= 时,开始生成Fe(OH)3沉淀(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠溶液中加入饱和KOH溶液,即可析出高铁酸钾。
①已知高铁酸钠和水反应,有Fe(OH)3和O2生成,则高铁酸钠的氧化性比O2 (填“强”或“弱”)。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
(3)高铁酸钾是一种理想的水处理剂,其处理水的原理为 。
(4)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
煤焦油中含有多种芳香族化合物,是重要的化工原料。以下是用煤焦油制备均三溴苯的流程。
42.操作①的名称是 ;试剂①是 ;反应②中,NaHS作 剂。
43.均三溴苯的系统命名为 。
44.不用硝基苯直接溴化制取均三溴苯,理由是 。
指出苯胺比苯更易发生取代反应的二个事实 。
45.苯胺是微溶于水的液体,呈弱碱性。若苯胺中含少量的苯和硝基苯,简述提纯步骤 。
46.氨基与羟基有许多相似的性质,则苯胺与醋酸酐[(CH3CO)2O]在一定条件下反应,除了生成CH3COOH外,生成的另一种有机物的结构简式为 。
某强酸性溶液X含有Ba2+、Al3+、NH 、Fe2+、Fe3+、CO
、Fe2+、Fe3+、CO 、SO
、SO 、SO
、SO 、Cl-、NO
、Cl-、NO 中的一种或几种,取该溶液进行实验,实验内容如下:
中的一种或几种,取该溶液进行实验,实验内容如下:
根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是_____________________________________;
(2)写出有关离子方程式:
步骤①中生成A__________________;步骤②生成沉淀I__________________。
(3)假设测定A、F、I均为0.01 mol,10 mL X溶液中n(H+)=0.04 mol,而沉淀C物质的量0.07 mol,能说明该溶液不能确定的阴离子存在的理由是___________________。
(14分)某化学小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4。已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。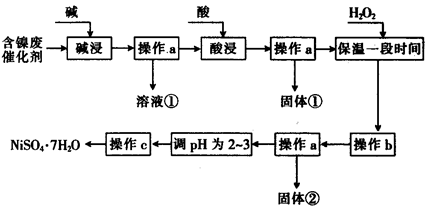
部分阳离子以氢氧化物形式沉淀时的pH如下: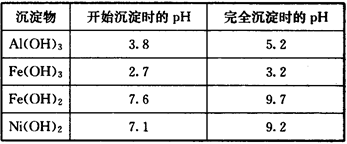
(1)“碱浸”过程中发生反应的离子方程式是
(2)“酸浸”时所加入的酸是 (填化学式)。
(3)加入H2O2时发生反应的离子方程式为
(4)操作b为调节溶液的pH,你认为pH的调控范围是
(5)产品晶体中有时会混有少量绿矾(FeS04·7H20),其原因可能是 (写出一点即可)。
(6)NiS04·7H20可用于制备镍氢电池(NiMH),镍氢电池目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中总反应的化学方程式是Ni(OH)2+M=NiOOH+MH,则NiMH电池放电过程中,正极的电极反应式为 。
常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源
(1)填充物用60℃温水溶解,目的是 。
(2)操作A的名称为 。
(3)铜帽溶解时加入H2O2的目的是 (用化学方程式表示)。
铜帽溶解完全后,可采用_____________方法除去溶液中过量的H2O2。
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为 。
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4=2MnSO4+4CO2↑+6H2O。
①当1 mol MnO2参加反应时,共有 mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,
试写出该反应的化学方程式: 。
(15分)某同学在探究废干电池内的黑色固体回收利用时,进行如图示实验: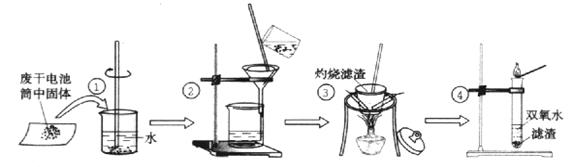
查阅教材可知,普通锌锰电池的黑色物质主要成分为MnO2、NH4Cl、ZnCl2等物质。请回答以下问题:
(1)操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、 、 、 ;
(2)操作④的试管加入③中所得黑色滤渣,试管中迅速产生能使带火星的木条复燃的气体,据此可初步认定黑色固体为 。
(3)操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测滤渣中还存在的物质为 。
(4)该同学要对滤液的成分进行检验,以确认是否含有NH4Cl和ZnCl2,
下面是他做完实验后所写的实验报告,请你写出其空白处的内容:
| 实验目的 |
操作 |
实验现象 |
结论 |
| 1、检验Cl— |
取少许滤液于试管中, , |
, |
含有Cl— |
| 2、检验NH4+ |
取少许滤液于试管中, , |
, |
含有NH4+ |
| 3、检验Zn2+ |
取少许滤液于试管中,加入 稀氨水 |
先产生白色沉淀,继续加入氨水,沉淀又溶解 |
含有Zn2+ |
(5)根据以上的实验报告,关于滤液的成分,你的结论是: 。通过一定的操作从滤液中得到固体溶质, 若要将所得固体溶质中的物质加以分离,可用 法。
过碳酸钠(2Na2CO3·3H2O2)俗称固体双氧水,是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的制备流程如下: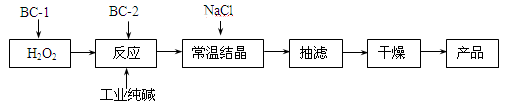
(注:BC-1、BC-2均为稳定剂,其中BC-1是由异丙醇和三乙醇胺按一定比例混合而成)
(1)结晶过程中加入氯化钠、搅拌,作用是 。
(2)加入BC-2稳定剂与工业纯碱中含有的Fe3+ 杂质生成稳定的配合物的目的是 。
(3)洗涤抽滤产品,应选用合适的洗涤试剂是 (填写序号)。
| A.饱和氯化钠溶液 | B.水 | C.异丙醇 | D.碳酸钠饱和溶液 |
(4)工业上常以活性氧的质量分数[ω(活性氧)=16 n(H2O2) / m(样品) ×100﹪]来衡量过碳酸钠产品的优劣,ω≥13﹪为优等品。现将0.2000g某厂家生产的过碳酸钠样品(所含杂质不参与后面的反应)溶于水配成溶液,加入适量稀硫酸酸化,再加入足量KI,摇匀后静置于暗处,充分反应后加入少量淀粉试剂,用0.1000mol/LNa2S2O3溶液滴定到终点,消耗Na2S2O3溶液33.00mL。(已知:2Na2S2O3+I2=Na2S4O6+2NaI),通过计算判断样品是否为优等品(写出计算过程)。
继侯德榜“联合制碱法”后,上世纪50年代某些化工专家开始研究有机胺制碱法,目前这项研究工作取得了一定进展。其工艺流程如下: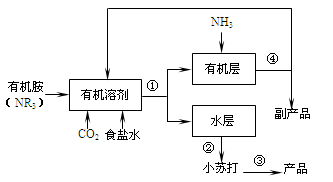
已知:NR3+ HC=NR3 •HCl,且NR3 •HCl易溶于有机溶剂。
(1)有机胺制碱法反应生成小苏打的化学方程式是: ;操作①称为 ;
(2)过程③得到产品的化学方程式是: ;
(3)在过程④中,回收有机胺的化学方程式是: ;
(4)副产品的用途 ;
(5)本工艺流程中可循环利用的物质是: 。
SiCl4是一种遇水强烈水解,并放出大量的热的化合物。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成分为BaCO3,且含有铁、镁等离子)来制备BaCl2·2H2O,工艺流程如下:
已知:①常温下Fe3+、Mg2+完全沉淀的pH分别是3.4、12.4。
②BaCO3的相对分子质量是197; BaCl2.2H2O的相对分子质量是244。
(1)SiCl4发生水解反应的化学方程式 。
(2)氮化硅(Si3N4)是一种高温结构材料,粉末状的Si3N4可以在高温条件下由SiCl4蒸汽与NH3反应得到,请写出该反应的化学方程式 。
(3)加钡矿粉调节pH=7的作用是:
①使BaCO3转化为BaCl2;② ;
(4)生成滤渣A的离子方程式: ;
(5)BaCl2滤液经 、 、过滤、洗涤,再经真空干燥后得到BaCl2.2H2O。
(6)10吨含78.8% BaCO3的钡矿粉理论上最多能生成BaCl2·2H2O_ 吨。
【化学——选修2化学与技术】
红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基本化工原料,应用领域十分广泛。
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO·Cr2O3)利用以下过程来制取。
①步骤I中反应的化学方程式为:4FeO·Cr2O3(s)+8Na2CO3(s)+7O2= 8Na2CrO4(s)+2Fe2O3(s)+8CO2
该反应的化学平衡常数的表达式为 。在常温下该反应速度极慢,下列措施中能使反应速率增大的是 。
| A.升高温度 | B.通入过量的空气 |
| C.将原料粉碎 | D.增加纯碱的用量 |
②步骤II中所得溶液显碱性,其中除含有Na2C rO4外还含有铝、硅元素的化合物,它们的化学式可能是 。
③步骤III需将溶液的pH调至7~8并煮沸,其目的是 。
④步骤Ⅳ中发生反应的离子方程式为:____。
(2)将红矾钠与KC1固体1:2(物质的量比)混合溶于水后经适当操作可得到K2Cr2O7晶体,反应方程式为:Na2CrO4 +2KCl= K2Cr2O7 +2NaCl(已知NaCl的溶解度受温度影响小,K2Cr2O7的溶解度受温度影响大),基本实验步骤为:①溶解;② ;③____ 。
④冷却、结晶,过滤,得到K2Cr2O7晶体。
海藻中富含碘元素。某小组同学在实验室里用灼烧海藻的灰分提取碘,流程如下图。
(1)写出操作名称:操作① ,操作③ 。
(2)用NaOH浓溶液反萃取后再加稀酸,可以分离I2和CCl4。有关化学方程式为:
碱性条件,3I2+6NaOH=5NaI+NaIO3+3H2O,
酸性条件,5NaI+NaIO3+3H2SO4=3Na2SO4+3I2+H2O。
以下是反萃取过程的操作,请填写相关空格:
①向装有I2的CCl4溶液的 (填仪器名称)中加入少量1mol·L-1 NaOH溶液;
②振荡至溶液的 色消失,静置、分层,则 (填“上”、“下”)层为CCl4;
③将含碘的碱溶液从仪器的 (填“上”、“下”)口倒入烧杯中;
④边搅拌边加入几滴1 mol·L-1 H2SO4溶液,溶液立即转为棕黄色,并析出碘晶体;
(3)本实验中可以循环利用的物质是 。
硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下: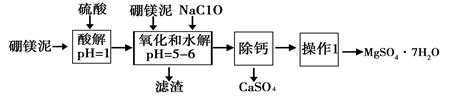
根据题意回答下列问题:
(1)实验中需用1 mol·L-1的硫酸80mL,若用98%的浓硫酸来配制,除量筒、玻璃棒外,还需要的玻璃仪器有 。
(2)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式: 。
(3)在调节pH=5~6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为: 。
(4)如何检验滤液中Fe3+是否被除尽,简述检验方法 。
(5)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) |
40 |
50 |
60 |
70 |
| MgSO4 |
30.9 |
33.4 |
35.6 |
36.9 |
| CaSO4 |
0.210 |
0.207 |
0.201 |
0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明主要操作步骤 、 。
(6)如果提供的硼镁泥共100 g,得到的MgSO4·7H2O 196.8 g,则MgSO4·7H2O的产率为 。
为探索工业含铝、铁、铜合金废料的再利用,某同学实验设计的回收利用方案如下:
(1)操作①的名称是 , 滤渣B含有 (填化学式)。
(2)反应①的离子方程式是 。
(3)若要从滤液D得到绿矾晶体,必须进行的实验操作步骤: 、冷却结晶、过滤、自然干燥,在这一系列操作中没有用到的仪器有 (填序号)。
A.漏斗 B.坩埚 C.烧杯 D.玻璃棒
(4)试剂Y应该是一种 (填“氧化剂”或“还原剂”),它不可能是 (填序号)。
A.H2O2 B.H2 C.O2 D.Fe
(原创)(1)除去碳酸钠固体中少量碳酸氢钠的方法是 ,化学方程式为 。
(2)高铁酸钠(Na2FeO4)具有强氧化性,可对自来水进行消毒、净化。高铁酸钠可用氢氧化铁和次氯酸钠在碱性介质中反应得到,请补充并配平下面离子方程式。
Fe(OH)3 + ClO-+ OH-=== FeO42-+ Cl-+ ( )
(3)某溶液中可能大量含有Mg2+、Cu2+、Al3+、Cl-、OH-、CO32-。当加入氢氧化钠溶液时,生成白色沉淀的
物质的量与加入氢氧化钠的物质的量关系如图所示。
则溶液中大量含有的离子有______________________,各离子的物质的量浓度之比为____ (与前面的离子顺序相对应)。
对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备。
一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在CCl4溶液中,加入乙酸酐(有脱水作用),45℃反应1h 。反应结束后,过滤,滤液分别用5% NaHCO3溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
(1)上述实验中过滤的目的是 。
(2)滤液在分液漏斗中洗涤静置后,有机层处于 层(填“上”或'下”);放液时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有 。
(3)下列给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
| 催化剂 |
n(催化剂) n(甲苯) |
硝化产物中各种异构体质量分数(%) |
总产率(%) |
||
| 对硝基甲苯 |
邻硝基甲苯 |
间硝基甲苯 |
|||
| 浓H2SO4 |
1.0 |
35.6 |
60.2 |
4.2 |
98.0 |
| 1.2 |
36.5 |
59.5 |
4.0 |
99.8 |
|
| NaHSO4 |
0.15 |
44.6 |
55.1 |
0.3 |
98.9 |
| 0.25 |
46.3 |
52.8 |
0.9 |
99.9 |
|
| 0.32 |
47.9 |
51.8 |
0.3 |
99.9 |
|
| 0.36 |
45.2 |
54.2 |
0.6 |
99.9 |
①NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为 。
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是 。
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有 。