陕西岐山县高一上学期期末质量检测化学试卷
下列关于钠的叙述中,不正确的是
| A.钠燃烧时发出黄色的火焰 | B.钠燃烧时生成氧化钠 |
| C.钠有很强的还原性 | D.钠原子的最外层只有一个电子 |
现在CO和CO2 两种气体,它们所含氧原子的物质的量均为1 mol ,则 CO 与CO2的分子数之比为
| A.1 :1 | B.1 :2 | C.2 :1 | D.3 :2 |
下列各组混合物可用如图装置分离的是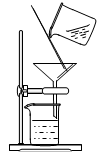
| A.汽油和植物油 |
| B.碳酸钙和水 |
| C.酒精和水 |
| D.四氯化碳和碘 |
“X”光透视常用钡餐作造影剂。钡餐的主要成分为硫酸钡,其化学式是BaSO4,BaSO4属于
| A.单质 | B.混合物 | C.化合物 | D.氧化物 |
“纳米材料”是指直径从几纳米至几十纳米的材料,目前已广泛应用于催化剂及军事技术中,如果将纳米材料分散到液体分散剂中,所得混合物
| A.不能透过滤纸 | B.一定是浊液 |
| C.一定是溶液 | D.有丁达尔效应 |
下列各组离子在溶液中为无色,且能大量共存的是
| A.Cu2+、SO42-、Na+、Cl- | B.Na+、CO32-、H+、K+ |
| C.Mg2+、H+、SO42-、NO3- | D.Ag+、NO3-、K+、Cl- |
除去Na2CO3固体中少量NaHCO3的最佳方法是
| A.加入适量盐酸 | B.加入NaOH溶液 |
| C.加热 | D.配成溶液后通入CO2 |
实验室需用500mL 0.1mol• L-1NaOH溶液,下列有关配制该溶液的说法中不正确的是
| A.应选用500mL的容量瓶 |
| B.应称取2.0g NaOH固体 |
| C.将称量的NaOH固体置于烧杯中用适量水溶解 |
| D.将溶解的NaOH溶液直接注入容量瓶中,再加入蒸馏水至刻度线 |
下列关于浓硝酸和浓硫酸的叙述中正确的是
| A.常温下均可用铝制容器运输 |
| B.露置在空气中,容器内酸液质量都减小 |
| C.常温下均能与铜较快反应 |
| D.露置在空气中,容器内酸液质量都增大 |
下列叙述正确的是
| A.SO42-的摩尔质量为96g• mol-1 |
| B.1mol物质的质量等于该物质的式量 |
| C.1molO2的质量为32 g• mol-1 |
| D.CO2的摩尔质量为44g |
下列化学方程式中,能用离子方程式:Ba2++ SO42-= BaSO4↓表示的是
| A.Ba(OH)2 + (NH4)2SO4 ="=" BaSO4↓ + 2NH3•H2O |
| B.Ba(OH)2 + H2SO4 ="=" BaSO4↓ + 2H2O |
| C.BaCO3 + H2SO4 ="=" BaSO4↓ + 2H2O + CO2↑ |
| D.BaCl2 + Na2SO4 ="=" BaSO4↓ + 2NaCl |
根据反应式:①2Fe3++2I- 2Fe2++I2和② Br2+2Fe2+
2Fe2++I2和② Br2+2Fe2+ 2Fe3++ 2Br-,可判断离子的还原性从强到弱的顺序是
2Fe3++ 2Br-,可判断离子的还原性从强到弱的顺序是
| A.Br-、Fe2+、I- | B.I-、Fe2+、Br- |
| C.Br-、I-、Fe2+ | D.Fe2+、I-、Br- |
下列各组物质相互反应能得到Al(OH)3的是
| A.铝与NaOH溶液反应 | B.AlCl3与过量的氨水反应 |
| C.AlCl3与过量的NaOH溶液反应 | D.Al2O3与过量的NaOH溶液反应 |
按要求写出下列反应的化学方程式:
①将一小块钠投入水中: 。
②氢氧化铝与氢氧化钠溶液反应: 。
③过氧化钠与水反应: 。
请分别选用一种试剂除去下列物质中的杂质,并写出相应的离子方程式。
| |
物质 |
杂质 |
所选试剂 |
离子方程式 |
| ① |
NaCl溶液 |
Na2CO3 |
|
|
| ② |
Mg粉 |
Al粉 |
|
|
已知氧化还原反应与四种基本反应类型的关系可用如图表示,
下列是有水参加或生成的几种反应:
①CaO + H2O ==Ca(OH)2
②2Na + H2O ="=" 2NaOH + H2↑
③H2 + CuO  Cu +H2O
Cu +H2O
④3S+6NaOH  2Na2S +Na2SO3 +3H2O
2Na2S +Na2SO3 +3H2O
⑤NaOH + HCl ="=" NaCl + H2O
请回答下列问题:
(1)反应①中水 (填字母)。
| A.是氧化剂 | B.是还原剂 |
| C.既是氧化剂又是还原剂 | D.既不是氧化剂又不是还原剂 |
(2)反应③被氧化的元素是 (填元素符号)。
(3)上述反应中,属于区域Ⅲ的是 (填序号)。
(4)写出一种符合区域Ⅴ且既有沉淀生成又有水生成的离子方程式: 。
下面是印刷电路板的生产及其废液的处理的流程简图。请按要求填空:
(1)镀铜电路版制成印刷电路版的离子方程式为 ;固体1的化学成分是 (填化学式)。
(2)反应①的化学方程式为 ;要检验废液中是否含有Fe3+所需的试剂是 (填化学式)溶液。
(3)反应④的离子方程式为 。
某小组同学要配制100 mL 0.100 mol·L-1 Na2CO3溶液。下图是一些关键步骤和操作。
(1)配制过程的先后顺序为(用字母A~F填写) 。
(2)配制过程所需的玻璃仪器有烧杯、玻璃棒、量筒、 。
(3)用Na2CO3·10H2O来配制溶液,若晶体已经部分失去结晶水,则所配得溶液的浓度会 (填“偏高”、“偏低”、“不变”)。
(4)步骤A通常称为洗涤,如果没有步骤A,则配得溶液的浓度将 (填“偏高”、“偏低”、“不变”);步骤F称为 ,如果俯视刻度线,配得溶液的浓度将 (填“偏高”、“偏低”、“不变”)。
(5)在步骤B之后,需 ,才进行下一步操作。
海藻中富含碘元素。某小组同学在实验室里用灼烧海藻的灰分提取碘,流程如下图。
(1)写出操作名称:操作① ,操作③ 。
(2)用NaOH浓溶液反萃取后再加稀酸,可以分离I2和CCl4。有关化学方程式为:
碱性条件,3I2+6NaOH=5NaI+NaIO3+3H2O,
酸性条件,5NaI+NaIO3+3H2SO4=3Na2SO4+3I2+H2O。
以下是反萃取过程的操作,请填写相关空格:
①向装有I2的CCl4溶液的 (填仪器名称)中加入少量1mol·L-1 NaOH溶液;
②振荡至溶液的 色消失,静置、分层,则 (填“上”、“下”)层为CCl4;
③将含碘的碱溶液从仪器的 (填“上”、“下”)口倒入烧杯中;
④边搅拌边加入几滴1 mol·L-1 H2SO4溶液,溶液立即转为棕黄色,并析出碘晶体;
(3)本实验中可以循环利用的物质是 。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号