下面是印刷电路板的生产及其废液的处理的流程简图。请按要求填空: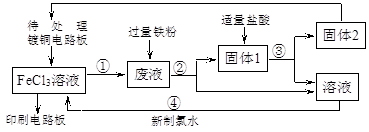
(1)镀铜电路版制成印刷电路版的离子方程式为 ;固体1的化学成分是 (填化学式)。
(2)反应①的化学方程式为 ;要检验废液中是否含有Fe3+所需的试剂是 (填化学式)溶液。
(3)反应④的离子方程式为 。
下面是印刷电路板的生产及其废液的处理的流程简图。请按要求填空: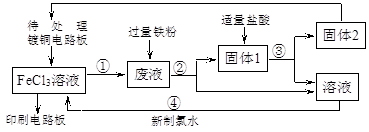
(1)镀铜电路版制成印刷电路版的离子方程式为 ;固体1的化学成分是 (填化学式)。
(2)反应①的化学方程式为 ;要检验废液中是否含有Fe3+所需的试剂是 (填化学式)溶液。
(3)反应④的离子方程式为 。