双氧水是一种重要的消毒剂,实验室可用下列流程制取双氧水,请根据转化关系图回答下列问题:
(1)电解槽中阳极反应式为 ,步骤②、③反应方程式分别为 、
(2)从步骤②得到K2S2O8、从步骤③得到H2O2溶液的操作分别是 。
| A.结晶分液 | B.过滤萃取 |
| C.过滤减压蒸馏 | D.蒸馏减压蒸溜 |
(3)整个实验过程中,能循环利用的物质是 。
(4)为测定产品中H2O2的浓度,量取样品50 mL,在250mL容量瓶中定容。准确量取25.00 mL于锥形瓶中,加入1 mL 6 mol·L—1的硫酸,然后用0.100 0 mol·L—1KMnO4标准溶液滴定,三次滴定平均消耗KMnO4溶液10.00 mL。
2MnO4— +5H2O2+6H+=2Mn2++ 5O2↑+8H2O
①如何判定滴定达到终点? 。
②根据滴定结果,可确定产品中H2O2的浓度为 g·L—1。
③若滴定前滴定管尖嘴处无气泡,滴定后产生气泡(其他操作均正确),会使测得的H2O2的浓度 (选填:“偏高”、“偏低”或“不变”)。
某强酸性溶液X含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、NO3-中的一种或几种,取该溶液进行连续实验,实验内容如下:
根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还肯定含有的离子是____________________,不能确定是否含有的离子是___________。
(2)沉淀G的化学式为_____________。
(3)①中生成A的离子方程式____________________。
(4)过滤操作中所使用到的玻璃仪器的名称为____________________。
(5)简述实验室检验气体F的方法 。
(本题共12分)葡萄糖酸钙是一种可促进骨骼生长的营养物质。葡萄糖酸钙可通过以下反应制得:C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→ (C6H11O7)2 Ca (葡萄糖酸钙)+H2O+CO2
相关物质的溶解性见下表:
| 物质名称 |
葡萄糖酸钙 |
葡萄糖酸 |
溴化钙 |
氯化钙 |
| 水中的溶解性 |
可溶于冷水 易溶于热水 |
可溶 |
易溶 |
易溶 |
| 乙醇中的溶解性 |
微溶 |
微溶 |
可溶 |
可溶 |
实验流程如下: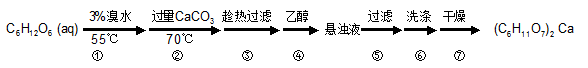
请回答下列问题:
32.第②步中所加CaCO3还发生了其他反应,写出其中一个主要反应的方程式________;充分反应后CaCO3固体需有剩余,目的是______________________;
33.第③步需趁热过滤,原因是______________________;
34.第④步加入乙醇的作用是______________________;
35.第⑥步中,下列洗涤剂最合适的是________。
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液
锌是人体健康所必需的元素,葡萄糖酸锌是一种常用的补锌剂,对婴儿及青少年的智力和身体发育有重要作用。工业上以葡萄糖酸钙为原料通过如下两步制备葡萄糖酸锌:
步骤1:充分反应后,过滤除去CaSO4沉淀。步骤2:将葡萄糖酸溶液与ZnO混合。
36.步骤2中,待其充分反应后,须继续加入葡萄糖酸溶液至pH为5.8,目的是 。
37.下列物质可替代ZnO的是 (填字母)。
a.NH3·H2O
b.Zn(OH)2
c.NaOH
d.ZnSO4
e.ZnCO3
(本题共12分)聚合氯化铝(PAC)的化学式为[Al2(OH)nCl6-n·xH2O]m,它是一种新兴的高效净水剂。
某兴趣小组尝试以工业废弃物铝灰为原料,利用酸溶法制备聚合氯化铝,主要流程如下:
完成下列填空:
40.用37.5%的浓盐酸配置100 mL 6 mol/L盐酸,所需的玻璃仪器有量筒、烧杯、_______。
41.步骤III调节pH至4.0~4.5,其目的是___________________________。为使得到的PAC晶体较纯净,所用的X物质可以是_______(填编号)。
a.氨水 b.铝 c.氢氧化铝 d.偏铝酸钠
42.步骤IV需要保持温度在85℃,可采用的加热方法是_____________。
43.为测定PAC样品中n的值,可以采用如下方法:
①称取一定质量样品,充分研碎后在_________(填仪器名称)中加热、灼烧至质量不再变化,得到1.020g固体,其成分是_________(填化学式)。
②另称取相同质量的样品,用_________(填化学式)溶解后,加入足量AgNO3溶液,得到3.157 g白色沉淀。
由上可知,该PAC样品中n的值为___________。
44.也可用烧碱溶解铝灰,再用稀盐酸调节pH至4.0~4.5,该法称为“碱溶法”。与“酸溶法”相比,“碱溶法”的缺点是______________________________(任写一点)。
(16分)用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。工艺流程如下(部分操作和条件略):
已知:一定条件下,MnO4 可与Mn2+反应生成MnO2
可与Mn2+反应生成MnO2
(1)稀H2SO4溶解Al2O3的离子方程式是__________________。
(2)已知:生成氢氧化物沉淀的pH如下表(注:金属离子的起始浓度为0.1mol·L-1)
上述流程中,加入过量KMnO4溶液的作用是________________________。(用离子方程式表示)
(3)向滤渣B中加入浓盐酸并加热,能说明沉淀中存在MnO2现象是____________。
上述流程中加入MnSO4体的目的是________________________。
操作a由一系列操作组成,分别是________、________、过滤。
(4)若用沉淀溶解平衡原理分析,操作a能析出A12(SO4)3·18H2O的原因是①____________②___________________
(14分)普通钢中加入少量的钒(V))能极大地改善钢的弹性和强度,使钢材既耐高温又抗奇寒,因此它有“合金维生素”之称。'T业上回收废钒催化剂(含有V2O5、VOSO4、K2SO4、SiO2) 中钒的主要流程如下: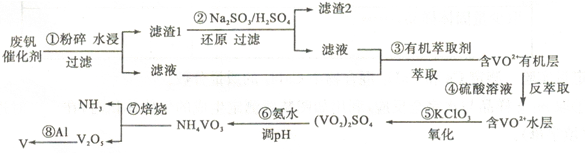
回答下列问题:
(1)滤渣l的主要成分是 。
(2)步骤②中发生反应的离子方程式为 。
(3)步骤③的变化过程可简化为(HA表示有机萃取剂):VOSO4 (水层)十2HAc(有机层) VOA2(有机层) 十H2SO4 (水层),则步骤④中可选择硫酸作萃取剂的原因是 。萃取和反萃取在实验室里用到的玻璃仪器有 和 。
VOA2(有机层) 十H2SO4 (水层),则步骤④中可选择硫酸作萃取剂的原因是 。萃取和反萃取在实验室里用到的玻璃仪器有 和 。
(4)该工艺流程中,可以循环利用的物质除了氨气以外,还有 。
(5)调节溶液pH,可将(VO2)SO4转变成NH4VO3沉淀。25℃时,当pH 为1. 7~1. 8 时,钒沉淀率为98. 8%,假设其它各步反应都完全进行,已知KC1O3的还原产物是KCl,若每消耗1 mol KC1O3,理论上可回收金属钒 g(计算结果保留一位小数)。
现有五种可溶性物质A、B、C、D、E, 它们所含的阴、阳离子互不相同,分别含有五种阳离子 Na+、Al3+、Mg2+、Ba2+、Fe3+ 和五种阴离子Cl-、OH-、NO3-、CO32-、X中的一种。
(1)某同学通过比较分析,认为无需检验就可判断其中必有的两种物质是
和 (填化学式,且相对分子质量小的写在第一个空);
(2)为了确定X,现将(1)中的两种物质记为A和B,含X的物质记C,当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时产生棕黄色沉淀(红白混合颜色),向该沉淀中滴人稀硝酸沉淀部分溶解,最后留有白色沉淀不再溶解。则X为 ;
A.SO32- B.SO42- C.CH3COO- D.SiO32-
(3)B的水溶液不显中性,原因为 (用离子方程式表示);
(4)将0. 02 molA与0.0 1molC同时溶解在足量的蒸馏水中,充分反应后,最终所得沉淀的质量为
(保留两位有效数字);
(5)将Cu投入到装有D溶液的试管中,Cu不溶解;再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。则物质D一定含有上述离子中的 (填相应的离子符号)。有关反应的离子方程式为: ;
(6)利用上述已经确定的物质,可以检验出D、E中的阳离子。请简述实验操作步骤、现象及结论 。
某强酸性溶液X含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行实验,实验内容如下: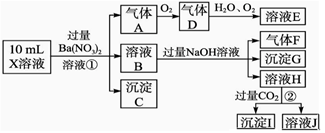
根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是_____________________________________;
(2)写出有关离子方程式:
步骤①中生成A__________________;步骤②生成沉淀I__________________。
(3)假设测定A、F、I均为0.01 mol,10 mL X溶液中n(H+)=0.04 mol,而沉淀C物质的量0.07 mol,能说明该溶液不能确定的阴离子存在的理由是___________________。
(12分)黄铜矿(主要成分为CuFeS2)是海洋矿物中的一种,它是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。请回答下列问题:
(1)利用黄铜矿冶炼铜的反应为8CuFeS2+21O2 Cu+4FeO+2Fe2O3+16SO2。已知CuFeS2中Fe的化合价为+2,Cu的化合价为+2,
Cu+4FeO+2Fe2O3+16SO2。已知CuFeS2中Fe的化合价为+2,Cu的化合价为+2,
①反应中被还原的元素是________(填元素符号),
②生成1 mol Fe2O3时转移电子的物质的量为________mol。
(2)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3,方法为:
①用过量稀盐酸浸取炉渣,过滤。
②先将滤液氧化,再向其中加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
据以上信息回答下列问题:
A.①中过滤的目的是____________________,
B.②中将滤液氧化常常选用H2O2,其反应的离子方程式为____________________。
C.只能选用提供的试剂,设计实验验证炉渣中含有FeO。提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、碘水,
①所选试剂为_
②证明炉渣中含有FeO的实验现象为
(12分)聚合硫酸铁铝(PFAS)是一种新型高效水处理剂。利用硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)为铁源、粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为铝源,制备PFAS的工艺流程如下:
(1)“碱溶”时,Al2O3发生反应的化学方程式为 。
(2)“酸溶Ⅱ”时,Fe3O4发生反应的离子方程式为 。
(3)“滤渣Ⅰ”、“滤渣Ⅱ”在本流程中能加以利用的是 。
(4)“氧化”时应控制温度不超过57℃,其原因是 。
(5)“氧化”时若用酸性高锰酸钾溶液代替,发生反应的离子方程式是 。
(6)酸度对絮凝效果和水质有显著影响。若产品中残留过多,使用时产生的不良后果是
常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。
(1)填充物用60℃温水溶解,目的是 。
(2)操作A的名称为 。
(3)铜帽溶解时加入H2O2的目的是 (用化学方程式表示)。铜帽溶解完全后,可采用_____________方法除去溶液中过量的H2O2。
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为 。
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4=2MnSO4+4CO2↑+6H2O。
①当1 mol MnO2参加反应时,共有 mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出该反应的化学方程式: 。
(6)锌锰干电池所含的汞可用KMnO4溶液吸收。在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如下图所示:
根据上图可知:
①pH对Hg吸收率的影响规律是随pH升高,汞的吸收率__ _.
②在强酸性环境下Hg的吸收率高的原因可能是KMnO4在酸性条件下 强.
某混合物,可能含有以下几种离子:K+、Cl-、NH4+、Mg2+、CO32-、Ba2+、SO42-,若将该混合物溶于水可得澄清溶液,现取3份各100 mL该溶液分别进行如下实验:
| 实验 序号 |
实验内容 |
实验结果 |
| 1 |
加AgNO3溶液 |
有白色沉淀生成 |
| 2 |
加足量NaOH溶液并加热 |
收集到气体1.12 L(已折算成标准状况下的体积) |
| 3 |
加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 |
第一次称量读数为6.63 g,第二次称量读数为4.66 g |
试回答下列问题:
(1)根据实验1对Cl-是否存在的判断是____________(填“一定存在”“一定不存在”或“不能确定”);根据实验1~3判断混合物中一定不存在的离子是____________。
(2)试确定溶液中一定存在的阴离子及其物质的量浓度((可以不填满,也可以增加)):
| 阴离子符号 |
物质的量浓度(mol/L) |
| |
|
| |
|
(3)试确定K+是否存在?________,如果存在物质的量浓度为__________,如果不存在理由是__ _。
孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:

请回答下列问题:
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①为______(填代号),检验溶液A中Fe3+的最佳试剂为 (填代号)。
a.KMnO4 b.(NH4) 2S c.H2O2 d.KSCN
(2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、 、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是 。
(3)制备CaCO3时,应向CaCl2溶液中先通入(或先加入) (填化学式),若实验过程中有氨气逸出,应选用下列 装置回收(填代号)。
 (4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应 ,直到 ,用KMnO4标准溶液滴定时应选用 滴定管(填“酸式”或“碱式”)。
(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应 ,直到 ,用KMnO4标准溶液滴定时应选用 滴定管(填“酸式”或“碱式”)。
已知:(A)Cu2+,Fe2+在pH为4~5的条件下不水解而Fe3+却几乎全部水解;(B)双氧水(H2O2)是强氧化剂,在酸性条件下,它的还原产物是H2O。用粗氧化铜(CuO中含少量Fe)制取CuCl2溶液过程如下:
①取50mL的盐酸,加入一定量的粗CuO加热搅拌,充分反应后过滤,溶液的pH是3
②向滤液中加入双氧水,搅拌。
③向②中加入过量纯CuO,微热,搅拌,此时测定溶液的pH为4,过滤。
④把③所得滤液浓缩。
(1)②中发生反应的离子方程式是 。
(2)③中过滤后滤渣的成分是 。
(3)①③中如何用pH试纸测定溶液的pH值: 。
(4)③中pH升高的原因是: 。(用离子方程式表示)
加碘食盐中含有的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解,碘酸钾的溶解度随温度升高变化不大。在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。工业生产碘酸钾的流程如下:
(1)步骤②中氢氧化钾的主要作用是 。
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,可经过 、过滤、洗涤、干燥等步骤。
(3)已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O; I2+2S2O32-=2I-+S4O62-
为了测定加碘食盐中碘的含量,某学生设计了如下实验:准确称取wg食盐,加适量蒸馏水使其完全溶解;再用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;最后加入指示剂,以物质的量浓度为2.00×10-3mol·L-1的Na2S2O3溶液滴定,消耗10.00mL时恰好反应完全。
①在滴定过程中,所用的玻璃仪器为 、 。
②该实验可以用 作指示剂,滴定终点的现象是 。
③下列有关该滴定实验的说法不正确的是 。
| A.滴定管在使用前必须检查是否漏水并润洗 |
| B.滴定时眼睛注视滴定管内溶液液面变化 |
| C.为减小实验误差,可用少量的蒸馏水冲洗锥形瓶内壁 |
| D.终点读数时俯视会导致碘的含量偏低 |
④加碘食盐样品中的碘元素含量是 g·kg-1(以含w的代数式表示)。