上海市闸北区高三上学期期末化学试卷
生活处处有化学,下列说法正确的是
| A.氢氧化铝可作胃酸过多的中和剂 |
| B.福尔马林可作食品的保鲜剂 |
| C.用聚乙烯塑料代替聚乳酸塑料可减少白色污染 |
| D.煎炸食物的花生油、牛油都属于可皂化的饱和酯类 |
关于 16O和18O的说法正确的是
| A.16O与18O互为同分异构体 |
| B.16O与18O核外电子排布不同 |
| C.通过化学变化可以实现16O与18O间的转化 |
| D.标准状况下,1.12L 16O2和1.12L18O2均含有0.1NA个氧原子 |
下列说法中正确的是
| A.摩尔是可以把物质的质量与微观粒子数联系起来的一个基本物理量 |
| B.0.012 kg 12C中所含的碳原子数为NA |
| C.物质的摩尔质量等于其相对分子(原子)质量 |
| D.1mol任何物质都含有约6.02×1023个原子 |
下列金属防腐的措施中,使用外加电流的阴极保护法的是
| A.水中的钢闸门连接电源的负极 | B.金属护拦表面涂漆 |
| C.枪炮的表面涂上一层机油 | D.地下钢管连接镁块 |
已知钡的某种同位素是 ,由学过的知识无法推断出的信息是
,由学过的知识无法推断出的信息是
| A.钡元素的相对原子质量 | B.钡元素在周期表中的位置 |
| C.钡原子的核电荷数 | D.钡原子的核外电子排布 |
欲证明一瓶无色液体是纯水,可靠的实验方法是
| A.测得其pH=7 | B.电解时得到H2与O2的体积比为2:1 |
| C.遇钠生成氢气 | D.1.01× 105Pa时沸点为100℃ |
有五种饱和溶液①Ba(NO3)2 ②Ca(OH)2 ③NaAlO2 ④Na2CO3 ⑤NH3和NaCl,分别持续通入CO2,最终得到沉淀或析出晶体的是
| A.①②③④⑤ | B.②③④⑤ | C.③④⑤ | D.③④ |
已知如下两个热化学反应方程式:
下列说法错误的是
| A.反应①、②都属于加成反应 |
| B.1,3—环己二烯比苯稳定 |
| C.反应①、②的热效应说明苯环中含有的并不是碳碳双键 |
| D.反应①、②中的所有有机物均可使溴水褪色,但褪色原理不完全相同 |
将40℃的饱和硫酸铜溶液升温至50℃,或者温度仍保持在40℃而加入少量无水硫酸铜,在这两种情况下均保持不变的是
| A.硫酸铜的溶解度 | B.溶液的质量 |
| C.溶液中溶质的质量分数 | D.溶液中Cu 的数目 的数目 |
关于三种有机物叙述错误的是(—SH的性质类似于—OH)
| A.都能发生酯化反应 |
| B.都能与NaOH反应 |
| C.甲的苯环上的一氯代物有4种 |
| D.丙的分子式为C10H15ON,苯环上的一氯代物有3种 |
常温下,向Na2CO3溶液中逐滴滴入0.1mol/L盐酸,溶液的pH随着滴入盐酸溶液体积变化曲线如下图,则下列说法正确的是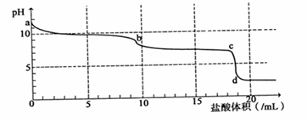
| A.a点时溶液pH=11.5,原因是:CO32-+2H2O → H2CO3+2OH- |
| B.a-b段发生反应为:CO32-+2H+→ CO2↑+H2O |
| C.b-c段发生反应为:HCO3-+H+→ CO2↑+H2O |
| D.c-d段发生反应为:H++OH-→ H2O |
除去被提纯物质中的杂质,方案正确的是
| 编号 |
被提纯的物质 |
杂质 |
除杂试剂 |
除杂方法 |
| A. |
CO2 (g) |
SO2(g) |
饱和Na2CO3溶液、浓H2SO4 |
洗气 |
| B. |
NaCl(s) |
KNO3(s) |
AgNO3溶液 |
过滤 |
| C. |
苯 |
苯酚 |
浓溴水 |
过滤 |
| D. |
苯 |
甲苯 |
KMnO4(酸化),NaOH溶液 |
分液 |
元素周期表中短周期的一部分如图,关于X、Y、Z、W、Q说法正确的是
| A.元素Y与元素Z的最高正化合价之和的数值等于9 |
| B.原子半径的大小顺序为:W>Z>Y |
| C.离子半径的大小顺序为:W2->Y2->Z3+ |
| D.W的气态氢化物的热稳定性和还原性均比Q强 |
碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间有如图所示关系,根据图示转化关系推测下列说法错误的是
| A.用KI淀粉试纸和食醋无法检验加碘盐中是否含有碘 |
| B.足量Cl2能使湿润的KI淀粉试纸变白的原因可能是:5Cl2+I2+6H2O→2HIO3+10HCl |
| C.由图可知氧化性的强弱顺序为Cl2>IO3->I2 |
| D.途径Ⅱ中若生成1 mol I2,反应中转移的电子数为10NA |
向含S2—、Fe2+、Br—、I—各0.1mol的溶液中通入Cl2,通入Cl2的体积(标准状况)和溶液中相关离子的物质的量关系图正确的是
可用下图所示装置制取、干燥、收集并吸收多余气体的是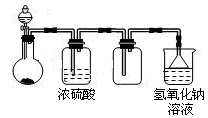
| A.浓氨水与氧化钙固体反应制氨气 |
| B.稀硫酸与硫化亚铁固体反应制硫化氢 |
| C.浓盐酸与次氯酸钙固体反应制氯气 |
| D.饱和食盐水与电石反应制乙炔 |
下表数据是对应物质的熔点,下列说法错误的是
| 编号 |
① |
② |
③ |
④ |
| 物质 |
AlF3 |
AlCl3 |
BCl3 |
NCl3 |
| 熔点/℃ |
1291 |
160 |
-107 |
-40 |
A.BCl3、NCl3分子中各原子最外层都满足8电子稳定结构
B.因为键长B-F< B-Cl,故BF3的熔点高于BCl3
C.AlF3、AlCl3都是强电解质,但晶体类型不同
D.BCl3为平面正三角形分子,故它是由极性键构成的非极性分子
25℃时,已知弱酸的电离常数:Ki(CH3COOH) =" 1.8" ×10-5;Ki1(H2CO3) =" 4.4" ×10-7;Ki2(H2CO3) =" 4.7" × 10-11;Ki(HClO) =" 4.0" ×10-8。则下列说法正确的是
| A.物质的量浓度相等的溶液pH关系:pH(NaClO)>pH(Na2CO3)>pH(CH3COONa) |
| B.向NaClO溶液中通少量CO2:CO2+ NaClO + H2O → NaHCO3+ HClO |
| C.a mol/L HClO与b mol/L NaOH溶液等体积混合后所得溶液中c(Na+)>c(ClO-),则a一定小于b |
| D.向氯水中加入NaHCO3固体,可以增大氯水中次氯酸的浓度 |
有人曾建议用AG表示溶液的酸度,AG的定义为:AG=lg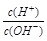 ,室温下实验室用0.01 mol/L的氢氧化钠溶液滴定20 mL相同浓度的醋酸溶液,滴定曲线如下图所示。下列有关叙述错误的是
,室温下实验室用0.01 mol/L的氢氧化钠溶液滴定20 mL相同浓度的醋酸溶液,滴定曲线如下图所示。下列有关叙述错误的是
| A.A点时加入氢氧化钠溶液体积为20 mL |
| B.室温时0.01 mol/L的醋酸溶液pH=4 |
| C.OA段溶液中:c(CH3COO-)> c(CH3COOH) |
| D.若B点时加入NaOH溶液40 mL,所得溶液中:c(CH3COO-)+2 c(CH3COOH) + c(H+) = c(OH-) |
铁、铜混合粉末18.0g加入到100ml 5.0mol/LFeCl3溶液中,剩余固体质量为3.2g。下列说法正确的是
| A.剩余固体是铁、铜混合物 |
| B.原固体混合物中铜的质量是9.6g |
| C.反应后溶液中n(Fe3+)="0.10" mol |
| D.反应后溶液中n(Fe2+)+ n(Cu2+)="0.75" mol |
(本题共12分)合成氨是人类科学技术发展史上的一项重大突破,解决了地球上因粮食不足而导致的饥饿与死亡。
23.氨分子的电子式为_________,氮元素原子最外层电子排布的轨道表示式是________。
24.在一容积为2 L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g),反应中NH3的物质的量浓度的变化情况如下图:
2NH3(g),反应中NH3的物质的量浓度的变化情况如下图:
根据上图,计算从反应开始到平衡时,氢气的平均反应速率为___________________。
25.催化剂存在下,NH3可用来消除NO的污染,生成两种对环境无害的物质。写出反应的化学方程式: ;该反应中氧化产物与还原产物的物质的量之比为 。
26.pH相同的氨水和氢氧化钠溶液,分别用蒸馏水稀释至原来体积的m倍和n倍,稀释后两溶液的pH仍相同,则m________n(填“>”、“<”或“=”);
27.氯碱工业的原料饱和食盐水中含有一定量的铵根离子,在电解时会生成性质极不稳定的三氯化氮,易引起爆炸。为除去饱和食盐水中的铵根离子,可在碱性条件下通入氯气,反应生成氮气。该反应的离子方程式为 。该工艺选择氯气的优点是 。(答出一点即可)
(本题共12分)氯化钙是典型的离子型卤化物。完成下列填空:
28.氯原子核外电子排布式为 ,其原子核外能量不同的电子有 种,最外层上有 种不同运动状态的电子,钙元素在元素周期表中位于 。
某研究小组以CaCl2和H2为原料,试图制备+1价Ca的化合物,结果发现产物中只有两种化合物甲和乙。元素组成分析表明化合物甲中钙、氯元素的质量分数分别为52.29%、46.41%;已知甲与水反应可得H2,乙的水溶液显酸性。
29.该研究小组是否成功制得了+1价Ca的化合物? (填“是”或“否”)。甲的化学式是 。
30.写出甲与水反应得H2的化学方程式 。现欲检验该反应所得溶液中是否含有Cl-,请简述检验的方法 。
31.乙的水溶液与Fe反应所得的溶液不稳定,保存该溶液的措施是 。
(本题共12分)葡萄糖酸钙是一种可促进骨骼生长的营养物质。葡萄糖酸钙可通过以下反应制得:C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→ (C6H11O7)2 Ca (葡萄糖酸钙)+H2O+CO2
相关物质的溶解性见下表:
| 物质名称 |
葡萄糖酸钙 |
葡萄糖酸 |
溴化钙 |
氯化钙 |
| 水中的溶解性 |
可溶于冷水 易溶于热水 |
可溶 |
易溶 |
易溶 |
| 乙醇中的溶解性 |
微溶 |
微溶 |
可溶 |
可溶 |
实验流程如下: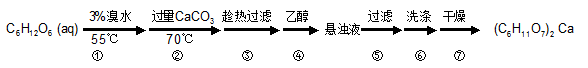
请回答下列问题:
32.第②步中所加CaCO3还发生了其他反应,写出其中一个主要反应的方程式________;充分反应后CaCO3固体需有剩余,目的是______________________;
33.第③步需趁热过滤,原因是______________________;
34.第④步加入乙醇的作用是______________________;
35.第⑥步中,下列洗涤剂最合适的是________。
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液
锌是人体健康所必需的元素,葡萄糖酸锌是一种常用的补锌剂,对婴儿及青少年的智力和身体发育有重要作用。工业上以葡萄糖酸钙为原料通过如下两步制备葡萄糖酸锌:
步骤1:充分反应后,过滤除去CaSO4沉淀。步骤2:将葡萄糖酸溶液与ZnO混合。
36.步骤2中,待其充分反应后,须继续加入葡萄糖酸溶液至pH为5.8,目的是 。
37.下列物质可替代ZnO的是 (填字母)。
a.NH3·H2O
b.Zn(OH)2
c.NaOH
d.ZnSO4
e.ZnCO3
(本题共12分)氯酸镁[ Mg(ClO3)2 ]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。
38.加速卤块在KMnO4溶液中溶解的措施有: (写出一点即可)。
39.加入MgO的作用是 ;过滤后所得滤渣的主要成分为 。
40.加入NaClO3饱和溶液后发生反应的化学方程式为 ,再进一步制Mg(ClO3)2·6H2O晶体的实验步骤依次为:①加热蒸发;② ;③ ;④过滤洗涤。
产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00 mL试液于锥形瓶中,加入10.00 mL稀硫酸和20 .00mL 1.000 mol/L的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol/L K2Cr2O7 溶液滴定剩余的Fe2+至终点。此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+→2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次
41.①写出步骤2中发生反应的离子方程式: ;
②步骤3中若滴定前不用标准液润洗滴定管,将会导致最终结果 (填“偏大”、“偏小”或“不变”);
42.若平均消耗K2Cr2O7 溶液15.00 mL,则产品中Mg(ClO3)2·6H2O的质量分数为 。
(本题共8分)炔烃与羰基化合物在强碱性条件下于乙醚中发生反应,可得到炔醇,反应原理为: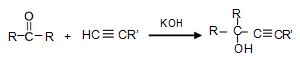
以下合成路线是某化工厂生产流程的一部分: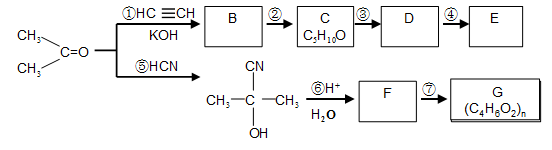
已知: 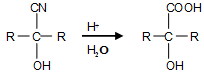
请回答下列问题:
43.写出C中含氧官能团的名称 。
44.有关C的说法正确的是
a.不能使酸性高锰酸钾褪色 b.能和氢氧化钠溶液反应
c.能使溴的四氯化碳溶液褪色 d.能与乙酸发生酯化反应
45.经测定,E的分子结构与天然橡胶结构相同,写出D的名称(系统命名) 。
46.⑤的反应类型是 ;B的结构简式是 。
47.写出反应⑦的化学方程式 。
(本题共14分)碘海醇为非离子型造影剂,尤适用于有造影剂反应的高危因素的病人。
下面是以化合物A为原料合成碘海醇的路线:
其中R-为-CH2CH(OH)CH2OH
请回答以下问题:
48.碘海醇的分子式为________。
49.A是苯的同系物,其蒸气相对氢气的密度是53,则A的结构简式是 。
50.写出A的侧链与氯气发生一氯取代的条件_____________。
51.反应①→⑤中,属于取代反应的是_____________(填序号)。
52.写出能同时满足下列条件的D的两种同分异构体的结构简式:________。
Ⅰ.苯环上有3个取代基,苯环上的一卤代物有2种;
Ⅱ.能发生银镜反应,水解产物之一能与FeCl3溶液发生显色反应;
Ⅲ.含有1个α-氨基酸的结构(例如: 属于α-氨基酸);
属于α-氨基酸);
53.已知:①
②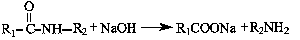
③ 呈弱碱性,易被氧化
呈弱碱性,易被氧化
请写出以  和(CH3CO)2O为原料制备染料中间体
和(CH3CO)2O为原料制备染料中间体 的合成路线流程图(无机试剂任用)。
的合成路线流程图(无机试剂任用)。
(合成路线常用的表示方式为: )
)
__________________________________________________________________________
(本题共14分)某课外兴趣小组成员为研究金属铜与强酸的反应,将9.6克铜粉分为三等份,进行了如下一些实验,请完成有关计算。
54.取其中一份与100mL一定浓度的硝酸反应,待固体完全溶解,产生的一氧化氮和二氧化氮混合气体在标准状况下的体积为0.896L。然后将剩余溶液稀释至1000mL,测得pH=0。请计算:生成的混合气体中一氧化氮的体积分数为______、反应前硝酸的物质的量浓度是__________。
55.再取另一份铜粉投入100mLpH=0的硫酸和硝酸混合液中,微热使反应充分完成后,生成一氧化氮气体448mL(标准状况)。求反应前混合溶液中所含硫酸的物质的量是多少?(写出计算过程)
56.用NaOH溶液吸收氮氧化物是防止NOx污染的一种方法。
原理为:2NO2+2NaOH→NaNO3+NaNO2+H2O,NO+NO2+2NaOH→2NaNO2+H2O
取最后一份铜粉溶于a mol/L过量的硝酸溶液30.0 ml中,假设硝酸的还原产物只有一氧化氮和二氧化氮。待反应结束后,将所剩溶液加水稀释至1000 m L,测得c(NO3-)=0.200 mol/L。若反应所生成的混合气体能被NaOH溶液完全吸收,试讨论a的取值范围。



 粤公网安备 44130202000953号
粤公网安备 44130202000953号