高铁酸盐是一种强氧化剂,在能源、环保等方面均有广泛的用途。湿法、干法制备高铁酸钾的原理如表所示:
| 湿法 |
强碱介质中,Fe(NO3)3与NaClO反应得到紫红色高铁酸盐溶液 |
| 干法 |
Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾(K2FeO4)和KNO2等产物 |
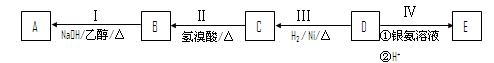
(1)某工厂用湿法制备高铁酸钾的流程如图所示:
①反应I的化学方程式为 。
②反应Ⅱ的离子方程式为 。
③已知25℃时Fe(OH)3的Ksp=4.0×10—38,反应Ⅱ后的溶液中c(Fe3+)=4.0×10—5mol·L—1.则需调整pH= 时,开始生成Fe(OH)3沉淀(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠溶液中加入饱和KOH溶液,即可析出高铁酸钾。
①已知高铁酸钠和水反应,有Fe(OH)3和O2生成,则高铁酸钠的氧化性比O2 (填“强”或“弱”)。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
(3)高铁酸钾是一种理想的水处理剂,其处理水的原理为 。
(4)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
 子为半满状态。请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
子为半满状态。请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
 ,气态M2+再失去一个电子比气态F2+再失去一个电子
,气态M2+再失去一个电子比气态F2+再失去一个电子
 离子,加入下列沉淀剂的顺序是(填序号)。
离子,加入下列沉淀剂的顺序是(填序号)。 得消毒液仅含一种溶质,写出相应的化学方程式:___________________________。
得消毒液仅含一种溶质,写出相应的化学方程式:___________________________。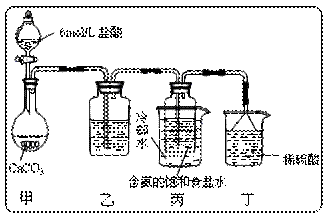
 粤公网安备 44130202000953号
粤公网安备 44130202000953号