(共14分)氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:
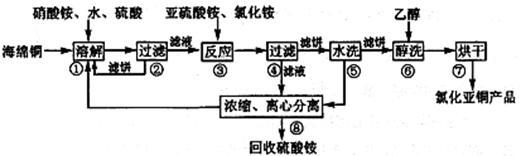
回答下列问题:
(1)步骤①中得到的氧化产物是_________,溶解温度应控制在60~ 70℃,原因是________ 。
(2)写出步骤③中主要反应的离子方程式___________。若向亚硫酸氢铵溶液中加入过量氢氧化钠溶液,反应的离子方程式为 。
(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是_________(写名称)。
(4)上述工艺中,步骤⑥不能省略,理由是________ _。
(5)准确称取所制备的氯化亚铜样品mg,将其置于过量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用amol/L的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液bmL,反应中Cr2O72-被还原为Cr3+,样品中CuCl的质量分数为__________。
某无色稀溶液X中,可能含有下表所列离子中的某几种。
| 阴离子 |
CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 |
Al3+、Fe3+、Mg2+、NH4+、Na+ |
现取该溶液适量,向其中加入某试剂Y,产生沉淀物质的量(n)与加入试剂的体积(V)关系如图所示。
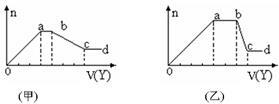
(1)若Y是盐酸,所得到的关系图如甲所示,则oa段转化为沉淀的离子(指来源于X溶液的,下同)是 ,ab段发生反应的离子 ,bc段发生反应的离子方程式 。
(2)若Y是NaOH溶液,所得到的关系图如乙所示,则X中一定含有的离子是 ,假设X溶液只含这几种离子,则溶液各离子物质的量之比为 ,ab段反应的离子方程式为 。
【化学——选修2:化学与技术】丙酮和苯酚都是重要的化工原料,工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下:

相关化合物的物理常数
| 物质 |
相对分子质量 |
密度(g/cm﹣3) |
沸点/℃ |
| 苯酚 |
94 |
1.0722 |
182 |
| 丙酮 |
58 |
0.7898 |
56.5 |
| 异丙苯 |
120 |
0.8640 |
153 |
回答下列问题:
(1)反应①和②分别在装置 和 中进行(填装置符号).
(2)反应②为 (填“放热”或“吸热”)反应.反应温度控制在50﹣60℃,温度过高的安全隐患是 .
(3)在反应器A中通入的X是 .
(4)在分解釜C中加入的Y为少量浓硫酸,其作用是 ,优点是用量少,缺点是 .
(5)中和釜D中加入的Z最适宜的是 (填编号.已知苯酚是一种弱酸)
a.NaOH b.CaCO3 c.NaHCO3 d.CaO
(6)蒸馏塔F中的馏出物T和P分别为 和 ,判断的依据是 .
(7)用该方法合成苯酚和丙酮的优点是 .
常见的五种盐X、Y、Z、M、N,它们的阴离子可能是SO42-、Cl-、NO3-、CO32-,阳离子可能是Ag+、NH4+、Na+、Al3+、Cu2+、Ba2+、Fe3+,已知:
①M的焰色反应呈黄色。
②五种盐均溶于水,水溶液均为无色。
③X的溶液呈中性,Y、Z、N的溶液呈酸性,M的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有X、Z的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,N和Z的溶液中生成沉淀,继续加氨水,Z中沉淀消失。
⑥把X的溶液分别加入到Y、Z、N的溶液中,均能生成不溶于稀硝酸的沉淀。
请回答下列问题:
(1)五种盐中,一定不含有的阳离子是________;所含阴离子相同的两种盐的化学式是__________。
(2)M的化学式为_________________,M溶液显碱性的原因是_____________(用离子方程式表示)。
(3)X和Z的溶液反应的离子方程式是________________;
N和氨水反应的离子方程式是____________。
(4)若要检验Y中所含的阳离子,正确的实验方法是__________________。
某待测溶液(阳离子为Na+)中可能含有SO42-、SO32-、NO3-、S2-、 Cl-、Br-、CO32-、HCO3-中的一种或多种,进行如图所示的实验,每次实验所加试剂均过量,回答以下问题:

(1)待测液中是否含有SO42-、SO32-:___________________。
(2)沉淀B的化学式为_________;生成沉淀B的离子方程式为____ __。
(3)根据以上实验,待测液中肯定没有的离子是__________;肯定存在的离子还有________。
过氧化钙(CaO2)是一种对环境友好的多功能无机化合物,通常有两种制备方法。
已知:温度过高过氧化钙会分解生成氧化物和氧气。
【方法1】由Ca(OH)2为原料最终制得,其制备流程如下:

【方法2】由鸡蛋壳(含CaCO3高达90%)为原料最终反应制得,其制备流程如下:
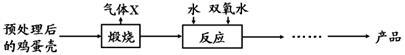
(1)方法1中搅拌的目的是 ;请将搅拌过程中发生反应的化学方程式补充完整:CaCl2 + H2O2
+ 2NH3·H2O + 6 = CaO2·8H2O↓+ 2NH4Cl;制备过程中除水外可循环使用的物质是 (填化学式)。
(2)方法2中气体X是 ,实验室常用 溶液来检验;煅烧后的反应是化合反应,也能生成CaO2·8H2O,反应的化学方程式为 ;该反应需控制温度在0~ 2℃,可将反应器放置在 中,获得CaO2产品中主要含有的固体杂质是 (填化学式)。
(3)这两种制法均要求在低温下进行(除煅烧外),温度过高除了防止氨水挥发外,还能 。
(4)“绿色化学”一般是指反应物的原子全部转化为期望的最终产物,则上述两种方法中生成CaO2·8H2O的反应符合“绿色化学”的是 (填“方法1”或“方法2”)。
磷酸铁(FePO4)为难溶于水的米白色固体,可用于制备药物、食品添加剂和锂离子电池的正极材料。实验室利用钛铁矿(主要成分为FeTiO3,含有少量MgO、CaO、SiO2等杂质)制备磷酸铁和锂离子电池正极材料(LiFePO4)的部分工业流程如图所示:
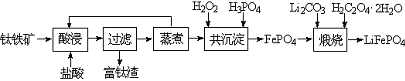
(1)富钛渣中的主要成分为TiO2和 (填化学式)。煅烧得到LiFePO4的化学方程式为 。
(2)在共沉淀步骤中加入H2O2的目的是让滤液中的Fe2+完全被H2O2氧化。
①反应的离子方程式为 。
②下列实验条件控制正确的是 (填序号)。
| A.加入适当过量的H2O2溶液 | B.缓慢滴加H2O2溶液并搅拌 |
| C.加热,使反应在较高温度下进行 | D.用氨水调节pH=7 |
(3)已知Ca2+、Mg2+和Fe3+离子形成磷酸盐的Ksp分别为2.0×10-29、1.0×10-24和9.9×10-16,若溶液中三种金属阳离子的浓度均为0.1 mol·L-1,则加入H3PO4时首先生成沉淀的化学式为 。
(4)制备LiFePO4的过程中,理论上所需 17%双氧水与H2C2O4·2H2O的质量比为 。
(5)钛铁矿中钛含量的测定步骤为:
①还原。将含钛试样溶解于强酸溶液中,再加入铝片将TiO2+还原为Ti3+,并将Fe3+还原。反应装置如图所示,使用封闭漏斗的目的是 。
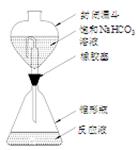
②滴定。取下封闭漏斗,向锥形瓶中加入2~3滴KSCN溶液,立即用FeCl3标准溶液滴定至终点,记录读数。
③计算。下列操作会导致测定结果偏低的是 。
a.还原操作结束后铝片有剩余
b.还原操作结束后,反应液仍呈黄色
c.缓慢滴定,且剧烈振荡锥形瓶,但无溶液溅出
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺流程如下:
请同答下列问题:
(1)写出向KOH溶液中通入足量Cl2发生反应的离子方程式_______ 。
(2)在溶液I中加入KOH固体的目的是______(填编号)。
| A.为下一步反应提供碱性的环境 |
| B.使KClO3转化为KClO |
| C.与溶液I中过量的Cl2继续反应,生成更多的KClO |
| D.KOH固体溶解时会放出较多的热量,有利于提高反应速率 |
(3)从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3,KCl,则反应③中发生的离子反应方程式为_______。每制得59.4克K2FeO4,理论上消耗氧化剂的物质的量为____ mol。
(4)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式:___ FeO42-+___ H2O="___" Fe(OH)3(胶体)+_____O2↑+___OH-。
银铜合金广泛应用于航空工业。从切割废料中回收银并制备铜的化工产品工艺如下:

(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)
(1)电解精炼银时,阴极反应式为 ;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学方程式为 。
(2)固体混合物B的组成为 ;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为 。
(3)完成煅烧过程中一个反应的化学方程式:
CuO + Al2O3 Cu AlO2 + ↑
Cu AlO2 + ↑
(4)若银铜合金中铜的质量分数为63.5%,理论上5.0kg废料中的铜可完全转化为______mol CuAlO2,至少需要1.0mol·L-1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制备胆矾,其基本操作是 、 、过滤、洗涤和干燥。
今有化合物: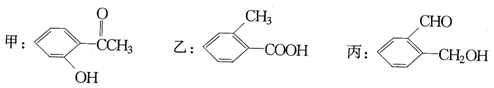
(1)请写出丙中含氧官能团的名称: 。
(2)请判别上述哪些化合物互为同分异构体: 。
(3)请分别写出鉴别甲、乙、丙化合物的方法。(指明所选试剂及主要现象即可)
鉴别甲的方法: ;
鉴别乙的方法: ;
鉴别丙的方法: 。
(4)请按酸性由强至弱排列甲、乙、丙的顺序: 。
(1)小苏打是某种治疗胃酸过多的胃药的主要成分,请写出该反应的离子方程式: 。
(2)在海水提溴过程中,吸收塔中用SO2和H2O将Br2转化成氢溴酸以达到富集的目的,请写出化学方程式: 。
(3)(NH4)2Fe(SO4)2属于盐类,溶于水后会电离出NH4+和Fe2+,写出检验的操作和现象:
a:检验Fe2+:取少量样品于试管中, ;
b:检验NH4+ :取适量样品于试管中, 。
(1)下列实验操作可以达到实验目的的是 (填序号,多填扣分)
| A.用铝片与四氧化三铁粉末混合加热进行铝热反应。 |
| B.向蔗糖溶液中加入稀硫酸,加热,冷却后加入新制Cu(OH)2检验水解产物。 |
| C.用酸性高锰酸钾溶液能鉴别乙烷与乙烯。 |
| D.用饱和Na2CO3溶液除去乙酸乙酯中的少量乙酸。 |
E.利用燃烧的方法可以鉴别出羊毛和棉花织品。
(2)请将下列物质的转化或分离方法的序号填在横线上(每一项只填写一种方法)。
a、蒸馏
b、裂解
c、过滤
d、裂化
e、干馏
f、分馏
g、电解
h、皂化
①把煤转化为焦炉气、煤焦油和焦炭等 ;
②从原油中分离出汽油、煤油、柴油等 ;
③将重油转化为汽油 ;
④将海水淡化 ;
⑤从海水得到的无水MgCl2中制取金属镁 ;
⑥用油脂制取肥皂_________________。
(每空2分,共8分)选择下列实验方法分离物质,将分离方法的序号填在横线上。
A、萃取法
B、加热分解
C、重结晶法
D、分液法
E、蒸馏法
F、过滤法
(1) 分离饱和食盐水和沙子的混合物;
(2) 从硝酸钾和氯化钠的混合溶液中获得硝酸钾;
(3) 从溴水中提取溴;
(4) 分离四氯化碳(沸点为76.75°C)和甲苯(沸点为110.6°C)的混合物,已知四氯化碳和甲苯互溶。
除去下列物质中含有的少量杂质,请选择合适的所给试剂、操作方法填入下表中(只填序号)
试剂:
| A.溴水 |
| B.NaOH溶液 |
| C.CaO |
| D.酸性KMnO4溶液 |
E.饱和Na2CO3溶液
操作方法:
a.蒸馏
b.分液
c.洗气
d.过滤
e.干馏
f.分馏
g.裂化
| 组别 |
物质 |
杂质 |
试剂 |
操作方法 |
| 1 |
乙烷 |
乙烯 |
|
|
| 2 |
溴苯 |
溴 |
|
|
| 3 |
乙酸乙酯 |
乙酸 |
|
|
| 4 |
乙醇 |
水 |
|
|
| 5 |
将重油转化为汽油 |
|
||
| 6 |
把煤转化为焦炉气、煤焦油和焦炭等 |
|
聚合硫酸铝铁[AlaFeb(OH)m(SO4)n·xH2O] 是一种新型高效净水剂,广泛应用于工业污染水的处理。
(1)聚合硫酸铝铁能够净水的原因是 。
(2)AlaFeb(OH)m(SO4)n·xH2O中a、b、m、n的代数关系式为 。
(3)为了测定聚合硫酸铝铁的组成,进行如下实验:
步骤一:准确称取8.810 g样品溶于150mL 0.100mol·L-1稀硫酸,恰好完全反应后,加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体10.485g;
步骤二:另取相同质量的样品,溶于过量的氢碘酸,以磁力搅拌机搅拌,充分反应后,以0.500 mol·L-1Na2S2O3溶液滴定至浅黄色,滴入几滴淀粉溶液,再滴定至终点,消耗Na2S2O3溶液20.00mL。(已知:I2+2Na2S2O3=2NaI+Na2S4O6)
①步骤二中使用磁力搅拌器进行搅拌的目的是 。
②通过计算确定聚合硫酸铝铁的化学式(写出计算过程)。