I.请回答:
(1)CO2的电子式 。
(2)钠燃烧不能用CO2灭火,用化学方程式表示其理由 。
(3)重晶石(BaSO4)不溶于酸,用饱和Na2CO3处理转化为易溶于酸的BaCO3,写出反应的离子方程式 。
(4)完成以下氧化还原反应的离子方程式:
( )Cr2O + ( )H2O2+ _____ =( ) Cr3++ ( ) O2 ↑+ ________
+ ( )H2O2+ _____ =( ) Cr3++ ( ) O2 ↑+ ________
II.化合物K3Fe(A2B4)3·3H2O是重要的催化剂。将化合物K3Fe(A2B4)3·3H2O受热完全分解,只得到气体产物和固体产物。经分析,气体产物只有甲、乙和水蒸气。已知甲、乙均由A、B两元素组成,且摩尔质量:M(甲)<M(乙)。A元素的最外层电子数是次外层电子数2倍,B元素的主族序数是其所在周期数的3倍。经分析,固体产物只有Fe、FeO 和K2AB3。某同学再进行以下定量分析。

(1)甲的化学式: 。
(2)溶液②与KMnO4发生氧化还原的离子方程式: 。
(3)由以上实验数据的分析可知n(Fe):n(FeO) :n(K2AB3) = : : 。
(4)某同学认为:溶液②由紫红色变为无色,振荡试样半分钟内不变色,即可证明溶液②与KMnO4溶液反应到达滴定终点。判断该同学设想的合理性并说明理由 。
某白色粉末由K2SO4、Na2CO3、NaCl和BaCl2中的两种或两种以上物质组成。为了鉴别该粉末的成分,某探究小组做了如下实验。
①取少量粉末溶于水,有白色沉淀生成。
②取少量粉末加入稀盐酸,有无色无味的气体产生。
根据上述实验现象回答下列问题:
(1)该粉末中一定含有 ,可能含有 。
(2)步骤②中反应的化学方程式为 。
(3)为了确定沉淀的成分,需要进行的操作是 。
室温下,现有A、B、C、D、E、F六种常见化合物,已知它们的阳离子有K+、Ag+、Ca2+、Ba2+、Fe2+、Al3+,阴离子有Cl-、OH-、CH3COO-、NO3-、SO42-、CO32-,现将它们分别配成0.1 mol/L的溶液,进行如下实验:(已知:室温下,饱和氢氧化钙溶液浓度约为0.00165 g/mL)
①测得溶液A、C、E呈碱性,且碱性为A > E > C;
②向B溶液中滴加Na2S溶液,出现难溶于强酸且阴阳离子个数比为1∶2的黑色沉淀;
③向D溶液中滴加Ba(NO3)2溶液,无明显现象;
④向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
根据上述实验现象,回答下列问题:
(1)写出下列化合物的化学式:A _____________、B _____________、C _____________。
(2)实验④中白色沉淀变为红褐色对应的化学方程式:_____________________________。
(3)D与E的溶液反应离子方程式是:__________________________________。
(共13分)
(1)混合物分离的方法在生产、生活和科学实验中有着广泛的应用。请指出下列做法中分别应用了哪些分离方法?
| A.分液 | B.过滤 |
| C.萃取 | D.蒸馏 |
E、蒸发结晶 F、加热分解
①除去Ca(OH)2溶液中悬浮的 CaCO3 ;②从碘水中提取碘 ;
③用自来水制取蒸馏水 ;④分离植物油和水 ;
⑤海水淡化 ;⑥除去 KCl 中少量 KClO3 ;
⑦熬煮中药 ;⑧用海水晒盐 。
(2)某同学要配制100mL 1mol·L-1NaCl溶液,配制时需选用的仪器主要有
, , , , 和试剂瓶。
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③160 g/L NaOH溶液是指160 g NaOH固体溶于水所得溶液的体积为1 L,其密度约为1.2g/mL。
(1)160 g·L-1 NaOH溶液的质量分数为 。
(2)发生器中鼓入空气的作用可能是_____________________(选填序号)。
a.将SO2氧化成SO3,增强酸性
b.稀释ClO2以防止爆炸
c.将NaClO3氧化成ClO2
(3)ClO2发生器中的主要反应方程式为 ,吸收塔内的反应的化学方程式为 。
(4)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是____________(选填序号)。
a.Na2O2 b.Na2S c.FeCl2
(5)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是____________(选填序号)。
a.蒸馏 b.蒸发 c.灼烧
d.过滤 e.冷却结晶
(10分)硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业.某研究小组设计SnSO4制备路线如下:

查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化.
Ⅱ.SnCl2易水解生成碱式氯化亚锡
回答下列问题:
(1)锡原子的核电荷数为50,与碳元素属于同一主族,锡元素在周期表中的位置是 .
(2)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因 .
(3)加入Sn粉的作用有两个:①调节溶液pH ② .
(4)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是 .
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是 .
常见的五种盐X、Y、Z、M、N,它们的阴离子可能是SO42-、Cl-、NO3-、CO32-,阳离子可能是Ag+、NH4+、Na+、Al3+、Cu2+、Ba2+、Fe3+,已知:
①M的焰色反应呈黄色。
②五种盐均溶于水,水溶液均为无色。
③X的溶液呈中性,Y、Z、N的溶液呈酸性,M的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有X、Z的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,N和Z的溶液中生成沉淀,继续加氨水,Z中沉淀消失。
⑥把X的溶液分别加入到Y、Z、N的溶液中,均能生成不溶于稀硝酸的沉淀。
请回答下列问题:
(1)五种盐中,所含阴离子相同的两种盐的化学式是__________________
(2)M溶液显碱性的原因是(用离子方程式表示)___________ __________
(3)X和Z的溶液反应的离子方程式是____________________
(4)N和氨水反应的离子方程式是__________________
(5)若要检验Y中所含的阳离子,正确的实验方法是_________________
【选修2:化学与技术】工业上用钛铁精矿(FeTiO3)提炼TiO2的工艺流程如下:
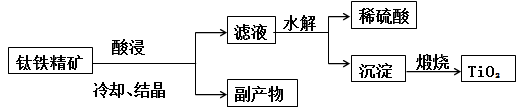
(1)酸浸时为了提高浸出率,请提出一种可行的措施____________。
(2)写出硫酸酸浸溶解钛铁精矿生成TiO2+的离子方程式_________________。
(3)钛铁精矿酸浸后经冷却、结晶得到的副产物A为 。
(4)结晶析出A时,需要保持较高的酸度而不能加水,其原因可能为 。
(5)工业上将TiO2和碳粉混合加热氯化生成的TiCl4,然后在高温下用金属镁还原TiCl4得到金属钛,写出TiO2制备Ti过程的化学方程式: 。
某固体混合物可能含Al、(NH4)2SO4、MgCl2、A1Cl3、FeCl2、NaCl中的一种或几种,现对该混合物作如下实验,所得现象和有关数据如图(气体体积已换算成标况下体积):
回答下列问题:

(1)混合物中是否存在FeCl2 (填“是”或“否”);
(2)混合物中是否存在(NH4)2SO4 (填“是”或“否”),你的判断依据是 。
(3)写出反应④的离子反应式: 。
(4)请根据计算结果判断混合物中是否含有AlCl3 (填“是”或“否”),你的判断依据是 。
海洋是巨大的化学资源宝库。下面是海水化学资源综合利用的部分流程图:

回答:
(1)由海水晒制的粗盐中含有Ca2+、Mg2+、SO42-等离子,为了除去这些离子,需要依次加入稍过量的NaOH、BaCl2、____(填试剂化学式),然后____(填操作名称)。在溶液中再加适量 (填试剂),加热蒸干溶液即得到精盐。
(2)某同学在实验室模拟氯碱工业的生产原理电解饱和食盐水。用玻璃棒蘸浓氨水检验阳极产生的气体,发现产生大量白烟。阳极生成的气体是 ,白烟的主要成分是 。
(3)制取MgCl2的过程中涉及反应:MgCl2·6H2O MgCl2 + 6H2O,该反应要在HCl气流中进行,原因是 。
MgCl2 + 6H2O,该反应要在HCl气流中进行,原因是 。
(4)苦卤中通入Cl2置换出Br2,吹出后用SO2吸收转化为Br-,反复多次,以达到富集溴的目的。由海水提溴过程中的反应可得出Cl-、SO2、Br-还原性由强到弱的顺序是 。
(5)工业上也可以用Na2CO3溶液吸收吹出的Br2,生成溴化钠和溴酸钠,同时有CO2放出。最后再用H2SO4处理得到Br2,最后一步反应的离子方程式是__________ 。
用霞石岩(主要成分为Na2O、K2O、Al2O3、SiO2)制碳酸钠、碳酸钾和氧化铝的工艺流程如下:已知:NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12。

溶解过滤工序产生的滤液中含钠、钾和铝的可溶性盐类,钙和硅等其他杂质在滤渣霞石泥中。部分物质的溶解度如上图,根据题意回答下列问题:
(1)固体M的化学式是________,X物质是________。
(2)实验室进行煅烧操作时盛放固体物质的实验仪器是________,滤液W中主要含有的离子有________。
(3)碳酸化Ⅰ中发生主要反应的离子方程式是____________。
(4)操作Ⅰ是________(填写名称),操作Ⅱ是________(选填编号)。
a.趁热过滤 b.冷却过滤 c.蒸馏 d.灼烧
(5)碳酸化Ⅱ调整pH=8的目的是______,产品K2CO3中最可能含有的杂质是__________(写化学式)。
(9分) 粉煤灰中含有SiO2、Al2O3、Fe2O3等,某实验室对其进行处理的流程如图所示:

回答下列问题:
(1)第①步得到的“熟料”中可溶性的成分主要是NH4Fe(SO4)2、NH4Al(SO4)2等,写出生成NH4Fe(SO4)2的化学方程式 。在物质分类体系中,NH4Fe(SO4)2、NH4Al(SO4)2不属于 (填字母)。
a.硫酸盐 b.复盐 c.强电解质 d.共价化合物
(2)滤渣B的主要成分为 。
(3)已知Ksp[Fe(OH)3]=4×10-38,Ksp [Al(OH)3]=1×10-32。为实现步骤③的实验目的,应使溶液中c(Fe3+)、c(Al3+)均小于或等于1×10-5 mol•L﹣1可认为完全沉淀,则溶液A至少应调节到pH=___。
(4)实验室进行第④步操作时,所需的主要仪器是酒精灯、三脚架、 、 ,得到的晶体主要成份是 (填化学式)。
某研究小组在实验室中将工厂废弃的合金,经过一系列的反应,制得氯化铝固体、硝酸铜晶体和铁红。其实验方案如下:
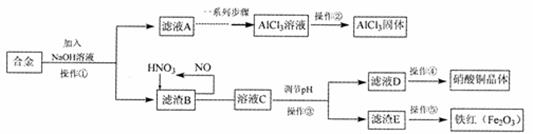
(1)该小组所用的合金中含有的金属为铁、 、 (填名称)。
(2)操作①、③使用的主要玻璃仪器是_,简述操作②的方法: 。操作④实验操作步骤包括:加热浓缩、冷却结晶、 (填操作名称)、洗涤、干燥。
(3)写出滤渣B中较活泼金属与足量稀HN03后发生反应的离子方程式: ;
(4)若该小组通过上述实验流程制得铁红80g,假设实验过程中无质量损失,则合金中铁的质量为 g;
(5)上述实验流程中符合“绿色化学”理念的做法是 (答出一点即可)。
饮水安全在人们生活中占有极为重要的地位,某研究小组提取三处被污染的水源进行了分析,给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质。A、B、C、D、E五种常见化合物都是由下表中的离子形成:
| 阳离子 |
K+ Na+ Cu2+ Al3+ |
| 阴离子 |
SO42- HCO3- NO3- OH- |
为了鉴别上述化合物,分别进行以下实验,其结果如下所示:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃片);④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验填空:
(1)写出B、D的化学式:B: ;D: 。
(2)将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为__________。
(3)写出实验②发生反应的离子方程式: 、 。
(4)C常用作净水剂,用离子方程式表示其净水原理: 。
工业碳酸钠(纯度约为98%)中常含有Ca2+、Mg2+、Fe3+、Clˉ和SO42ˉ等杂质,为了提纯工业碳酸钠,并获得试剂级碳酸钠的工艺流程图如下:
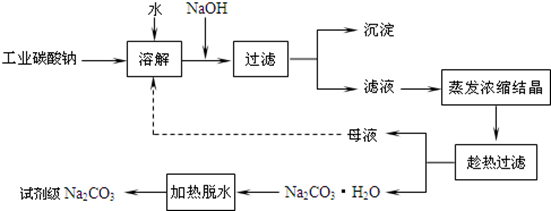
已知:碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:
(1)加入NaOH溶液时发生的离子反应方程式为 、 。
(2)热的Na2CO3溶液有较强的去油污能力,其原因是(用离子方程式及必要的文字加以解释) 。
(3)“趁热过滤”时的温度应控制在 。
(4)已知:Na2CO3·10 H2O(s)=Na2CO3(s)+10 H2O(g) △H=+532.36kJ·mol—1
Na2CO3·10 H2O(s)=Na2CO3·H2O(s)+9 H2O(g) △H=+473.63kJ·mol—1
写出Na2CO3·H2O脱水反应的热化学方程式 。
(5)有人从“绿色化学”角度设想将“母液”沿流程图中虚线所示进行循环使用。请你分析实际生产中是否可行 ,其理由是 。