安徽合肥168中高一上开学考试化学试卷
“生活垃圾分类”活动,对提升城市文明和生活质量具有积极的意义。下列四个图为城市生活垃圾分类的标志,则废弃旧电池属于
“两型”社会,提倡“低碳”生活,下列有关碳及碳的化合物叙述中正确的是
| A.二氧化碳是形成酸雨的主要气体 |
| B.金刚石、石墨都是碳单质,两者碳原子的排列方式相同 |
| C.一氧化碳含量增加会导致温室效应 |
| D.大气中二氧化碳的消耗途径主要是绿色植物的光合作用 |
我们的衣食住行中都蕴含着丰富的化学知识,下列说法中正确的是
| A.衣料中的蚕丝和涤纶都属于合成有机高分子材料 |
| B.加碘食盐和铁强化酱油都可以补充人体必需的微量元素 |
| C.建筑高楼大厦时用到的钢是纯净物 |
| D.用液化石油气代替汽油作汽车燃料,不会造成空气污染 |
下列实验操作能达到实验目的的是
| 选项 |
实验目的 |
实验操作 |
| A |
验证NaCl溶液中混有盐酸 |
取少量溶液,滴加无色酚酞溶液 |
| B |
比较Fe、Cu、Ag的金属活动性 |
铁丝浸入CuSO4溶液,铜丝浸入AgNO3溶液 |
| C |
除去铁制品上的铁锈 |
将铁制品长时间浸泡在足量的稀硫酸中 |
| D |
除去粗盐中的难溶性杂质 |
将粗盐研碎、溶解、蒸发 |
甲烷和水反应可以制水煤气(混合气体),其反应的微观示意图如图所示,根据以上微观示意图得出的结论中,正确的是
| A.反应前后各元素的化合价均不变 |
| B.水煤气的成分是一氧化碳和氧气 |
| C.该反应中含氢元素的化合物有3种 |
| D.该反应的化学方程式中甲烷和水的计量数之比为1︰1 |
如图所示,将少量液体X加入到烧瓶中,观察到气球逐渐膨胀。如表中液体X和固体Y的组合,不符合题意的是


| |
① |
② |
③ |
④ |
| X |
水 |
水 |
稀硫酸 |
双氧水 |
| Y |
硝酸铵 |
氢氧化钠 |
氯化钠 |
二氧化锰 |
A.①③ B.②④ C.①② D.③④
运用推理、归纳、类比、对比的方法得出下列结论,其中合理的是
| A.铝的金属活动性比铁强,则铝制品比铁制品更易锈蚀 |
| B.水和过氧化氢的组成元素相同,则二者的化学性质相同 |
| C.Na+、Mg2+、Cl-的最外层电子数均为8,由此得出离子的最外层电子数均为8 |
| D.同温下分解氯酸钾,加催化剂的反应速率更快,说明催化剂可以改变反应速率 |
下列图像能正确反映对应的实验操作的是
| A.向一定量的饱和石灰水中加入氧化钙 | B.加热一定量高锰酸钾固体产生氧气 |
| C.用一定量的双氧水制取氧气 | D.向一定量的硝酸银溶液中插入铜丝 |
KCl与KNO3在不同温度的溶解度数据如右表。则下列说法正确的是
| 温度/℃ |
10 |
20 |
30 |
40 |
50 |
| KCl |
30g |
33g |
35g |
38g |
41g |
| KNO3 |
21g |
31g |
45g |
65g |
88g |
A.KNO3比KCl的溶解度大
B.两种物质的溶解度相等的温度在20~30℃间
C.在20℃时,10g水中加入5gKCl可得到33.3%的KCl溶液
D.在50℃时,两物质各5g分别加入l0g水中,充分溶解,均有固体剩余
合金是重要的金属材料。
(1)下列物品所使用的主要材料属于合金的是 (填字母序号,下同)。
A.青花瓷瓶 B.橡胶充气艇 C.不锈钢锅
(2)生铁是常用的合金,生铁属于 (填“纯净物”或“混合物”)。
(3)黄铜是铜锌合金,将纯铜片和黄铜片互相刻画(如图所示),纯铜片上留下明显的划痕,说明 。

(4)黄铜渣中约含 、
、 、
、 、
、 ,其余为杂质.处理黄铜渣可得到硫酸锌,其主要流程如下(杂质不溶于水、不参与反应):
,其余为杂质.处理黄铜渣可得到硫酸锌,其主要流程如下(杂质不溶于水、不参与反应):

已知: ;
; 
①II中反应的化学方程式为 ;
②下列说法正确的是 。
a.I、II中的操作均包含过滤 b.溶液A中 的质量大于
的质量大于
c.溶液A 的质量小于溶液B d.溶液C中溶质的质量分数小于溶液B
请结合下图回答问题:

(1)写出有标号的仪器名称:① ,② 。
(2)实验室用高锰酸钾制取O2的化学方程式为 ,用A、C装置制取O2时,为防止高锰酸钾进入导管,可采取的措施是 。
(3)实验室用B、D装置制取CO2的化学方程式为 ,若将发生装置由B改为F,其优点是 。
(4)SO2是无色有刺激性气味的有毒气体,密度比空气大,易溶于水。SO2的某些化学性质与CO2相似,实验中常用NaOH溶液吸收SO2尾气。用下图所示装置收集一瓶干燥的SO2,装置中导管按气流方向连接顺序是 →⑤(填序号);图中漏斗的作用是 ;烧杯中NaOH溶液的作用是 (用化学方程式表示)。

过氧化钙(CaO2)是一种对环境友好的多功能无机化合物,通常有两种制备方法。
已知:温度过高过氧化钙会分解生成氧化物和氧气。
【方法1】由Ca(OH)2为原料最终制得,其制备流程如下:

【方法2】由鸡蛋壳(含CaCO3高达90%)为原料最终反应制得,其制备流程如下:
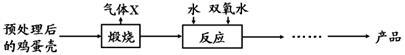
(1)方法1中搅拌的目的是 ;请将搅拌过程中发生反应的化学方程式补充完整:CaCl2 + H2O2
+ 2NH3·H2O + 6 = CaO2·8H2O↓+ 2NH4Cl;制备过程中除水外可循环使用的物质是 (填化学式)。
(2)方法2中气体X是 ,实验室常用 溶液来检验;煅烧后的反应是化合反应,也能生成CaO2·8H2O,反应的化学方程式为 ;该反应需控制温度在0~ 2℃,可将反应器放置在 中,获得CaO2产品中主要含有的固体杂质是 (填化学式)。
(3)这两种制法均要求在低温下进行(除煅烧外),温度过高除了防止氨水挥发外,还能 。
(4)“绿色化学”一般是指反应物的原子全部转化为期望的最终产物,则上述两种方法中生成CaO2·8H2O的反应符合“绿色化学”的是 (填“方法1”或“方法2”)。
某兴趣小组对物质的性质进行相关探究。
【提出问题】氯化氢(HCl)气体显酸性吗?
【进行实验】该兴趣小组的同学根据二氧化碳与水反应的实验探究方法,用三朵由紫甘蓝的汁液染成蓝紫色的纸质干燥小花进行如图1的三个实验:

实验现象:I和Ⅱ中小花不变色;Ⅲ中小花变红色。
【查阅资料】图2是同学们查阅的氯化氢气体溶于水的微观示意图。
【实验结论】氯化氢气体不显酸性。
【交流反思】
(1)从微观角度分析氯化氢气体不显酸性的原因是 。
(2)小明向实验Ⅲ中变红的小花上喷适当过量的稀氢氧化钠溶液,发现小花最后变成黄绿色,写出相关反应的化学方程式 。
(3)紫甘蓝的汁液在酸性溶液中显 色,在碱性溶液中显 色。
(4)下列实验可以用来说明氯化氢气体不显酸性的是 。
| A.测试盐酸的导电性,盐酸能导电 |
| B.干燥的碳酸钠粉末放人氯化氢气体中,不反应 |
| C.氢气与氯气反应,生成氯化氢气体 |
| D.干燥的碳酸钠粉末放人盐酸中,能反应 |
2015年8月12日晚天津开发区化工厂发生爆炸事故。化工厂里面有各种危险化学品,其中有一种叫电石的固体,其主要成分为碳化钙(CaC2),可与水反应生成可燃性气体乙炔(C2H2),十分危险,同时生成一种白色固体。
【提出问题】白色固体是什么物质?
【作出猜想】猜想一:CaO;
猜想二: ;
猜想三:Ca(OH)2。
进行上述猜想的依据是 。
【交流与反思】经过同学们交流讨论,认为猜想一不成立。否定猜想一的理由是 (用化学方程式说明)。
【进行实验】(一)取少量白色固体放入试管中,滴入稀盐酸,没有观察到 ,证明猜想二不成立。
(二)取少量白色固体加入水中,取上层清液,加入 ,有白色沉淀出现,证明猜想三成立。碳化钙与水反应的方程式为 。
某厂排放的废水中含有碳酸钠,未经处理,会造成污染。化学兴趣小组的同学对废水处理设计了如图所示的实验方案。试计算:

(1)反应生成CO2气体的质量是 g。
(2)反应后所得溶液中溶质的质量分数?
某溶液中含有较大量的Cl-、CO32-、OH-等三种阴离子,如果只取一次该溶液就能够分别将三种阴离子依次检验出来,下列实验操作顺序正确的是
①滴加Mg(NO3)2溶液 ②过滤 ③滴加AgNO3溶液 ④滴加Ba(NO3)2溶液
| A.①②④②③ | B.④②①②③ | C.①②③②④ | D.④②③②① |
用NA表示阿伏加德罗常数,则下列说法正确是
| A.常温常压下,11.2L CH4中含有的氢原子数为2NA |
| B.11.2 L CO2与8.5 g NH3所含分子数相等 |
| C.常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA |
| D.常温下,1L 0.1mol/L MgCl2溶液中含Cl-数为0.1NA |
下列说法正确的是
| A.标准状况下22.4L/mol 就是气体摩尔体积 |
| B.非标准状况下,1mol 任何气体的体积不可能为22.4L |
| C.标准状况下22.4L 任何气体都含有约6.02×1023个分子 |
| D.1mol H2和O2的混合气体在标准状况下的体积约为44.8L |
用10 mL 的0.1 mol•L-1BaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的物质的量浓度之比是
| A.3∶2∶2 | B.1∶2∶3 | C.1∶3∶3 | D.3∶1∶1 |
下列离子方程式错误的是
| A.铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
| B.盐酸与氢氧化钡溶液: H++OH-=H2O |
| C.碳酸钙与稀硝酸:CaCO3+2H+=2Ca2++ CO2↑+H2O |
| D.硫酸铜溶液与氢氧化钡溶液:Cu2++SO42-+Ba2++2OH-=Cu(OH)2↓+BaSO4↓ |
氢化钙(CaH2)可作为生氢剂,反应的化学方程式为CaH2+2H2O=Ca(OH)2+2H2↑,下列说法不正确的是
| A.CaH2既是还原剂,又是氧化剂 | B.H2既是氧化产物,又是还原产物 |
| C.CaH2是还原剂,H2O 是氧化剂 | D.氧化产物与还原产物质量比为1∶1 |
对四种无色溶液进行离子检验,检验结果如下,其中明显不正确的是
| A.SO42- OH- Cl- K+ | B.Na+ NO3- OH- Cl- |
| C.K+ Na+ NO3- Cl- | D.K+ CO32+ H+ Ba2+ |
已知下列反应:①2Na+2H2O=2NaOH+H2↑ ②2F2+2H2O=4HF+O2③Cl2+H2O=HCl+HClO
④2NaCl+2H2O通电2NaOH+H2↑+ Cl2↑⑤CaO+H2O=Ca(OH)2⑥CaCO3+H2O+CO2=Ca(HCO3)2
(1)其中水在反应中作氧化剂的反应是(填代号下同) 。
(2)其中水在反应中作还原剂的反应是 。
(3)其中水在反应中既不作氧化剂也不作还原剂的反应是 。
海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:

请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是_________(从下列仪器中选出所需的仪器,用标号字母填写空白处)。
| A.烧杯 |
| B.坩埚 |
| C.表面皿 |
| D.泥三角 |
E.酒精灯
F.干燥器
(2)步骤③的实验操作名称是 ;步骤⑥的目的是从含碘的苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 。
(3)步骤④反应的离子方程式是 。
(4)步骤⑤中,某学生选择用苯来提取碘的理由是 。
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法: 。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号