[化学—选修3物质结构与性质】(巧分)已知A, B、C、D, E, F为元素周期表前四周期原子序数依次增大的六种元素,其中A的一种同位素原子中无中子,B的一种核素在考古时常用来鉴定一些文物的年代,D与E同主族,且E的原子序数是D的2倍,F元素在地壳中的含量位于金属元素的第二位。试回答下列问题:
(l)F元素的价层电子排布式为 。
(2)关于B2A2的下列说法中正确的是 (填选项序号)。
①B2A2中的所有原子都满足8电子稳定结构
②B2A2是由极性键和非极性键构形成的非极性分子
③每个B2A2分子中 键和
键和 键数目比为1:1
键数目比为1:1
④B2A2分子中的A-B键属于 键
键
(3)B,C,D三种元素第一电离能按由大到小的顺序排列为 (用元素符号表示) B、C、D三种元素中与BD2互为等电子体的分子式为 (用元素符号表示)
(4)A2E分子中心原子的杂化类型为_____。比较A2D与A2E分子的沸点,其中沸点较高的原因为 。元素D可形成两种同素异形体,其中在水中溶解度更大的是 (填分子式)。
(5) F单质的晶体在不同温度下有两种堆积方式,信息如下:
则方式I与方式II中F原子配位数之比为 ,晶体密度之比为 。
已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素。其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外价电子数与B相同,其余各层均充满。B、E两元素组成化合物B2E的晶体为离子晶体。C、F的原子均有三个能层,C原子的第一至第四电离能(KJ·mol-1)分别为578、1817、2745、11575;C与F能形成原子数目比为1∶3、熔点为190 ℃的化合物Q。
(1)B的单质晶体为体心立方堆积模型,其配位数为____________;E元素的最高价氧化物分子的立体构型是________________。F元素原子的核外电子排布式是_______________,G的高价离子与A的简单氢化物形成的配离子的化学式为________________。
(2)试比较B、D分别与F形成的化合物的熔点高低并说明理由________________。
(3)A、G形成某种化合物的晶胞结构如图所示。若阿伏加德罗常数为NA,该化合物晶体的密度为a g·cm-3,其晶胞的边长为________ cm。
(4)在1.01×105 Pa、T1℃时,气体摩尔体积为53.4 L·mol-1,实验测得Q的气态密度为5.00 g·L-1,则此时Q的组成为________________。
原子序数小于36的X、Y、Z、W四种元素,其X是形成化合物种类最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。回答下列问题:
1)Y2X2分子中Y原子轨道的杂化类型为 ,1mol Y2X2含有σ键的数目为 。
2)化合物ZX3的沸点比化合物YX4的高,其主要原因是 。
3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是 。
4)元素W的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是 ,它可与浓盐酸发生非氧化还原反应,生成配合物HnWCl3,反应的化学方程式为 。
氮、磷、锌是与生命活动密不可分的元素。请回答下列问题:
(1)NH3和pH3都是极性分子,其中极性较大的是______,理由是______。
(2)NH4NO3是一种重要的化学肥料,其中N原子的杂化方式是______。
(3)氮化硼(BN)的一种晶体结构与金刚石相似,则B-N-B之间的夹角是____________。氮化砸的密度为3.52g/cm3,则B-N键的键长是______pm (只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
(4)已知磷酸分子中,P、O原子均满足最外层8个电子的稳定结构,则:
①P与非羟基O之间的共价键的形成方式是____________;
②中和20mL0.1mol/L次磷酸(H3PO2)溶液需要0.1mo/L NaOH溶液的体积恰好为20 mL,则H3PO2的结构式是____________。
(5)Zn2+基态时的电子排布式是______,ZnO和ZnS的晶体结构相似,其中熔点较高的是______,理由是________________________
水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子核外电子排布图为______________________________;
(2)写出与H2O分子互为等电子体的微粒______________________(填2种);
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是___________;
| A.氧原子的杂化类型发生了改变 | B.微粒的形状发生了改变 |
| C.微粒的化学性质发生了改变 | D.微粒中的键角发生了改变 |
(4)在冰晶体中,以一个水分子为中心,画出水分子间最基本的连接方式(水分子用结构式表示);
(5)下列是钾、碘、金刚石、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是_____,D晶体的空间利用率为 。
卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)卤素互化物如IBr ICl等与卤素单质结构相似、性质相近。Cl2、IBr、ICl沸点由髙到低的顺序为
_____,I和Cl相比,电负性较大的是_____。
(2)基态溴原子的电子排布式为_____,碘原子价电子的电子排布图为_____。
(3)I3+属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为______,中心I原子的杂化轨道类型为
__________。
(4)请推测①HClO4、②HIO4、③H5IO6[可写成(HO)5IO]三种物质的酸性由强到弱的顺序为_______(填序号)。
(5) 离子化合物RbICl2存在复合阴离子,且晶体结构与NaCl相似,晶胞边长为685.5pm( pm=10-12m), RbICl2晶胞中含有______个氯原子,RbICl2晶体的密度是_____g•cm3(只要求列箅式,不必计算出数值。阿伏伽德罗常数为NA)。
太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置。其材料除单晶硅,还有铜铟镓硒等化合物。

(1)镓的基态原子的电子排布式是 。
(2)硒为第4周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为 (用元素符号表示)。
(3)气态SeO3分子的立体构型为________。
(4)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是:_________________________________。
(5)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-而体现一元弱酸的性质,则[B(OH)4]-中B的原子杂化类型为 ;
(6)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的离子方程式为 ;
(7)一种铜金合金晶体具有面心立方最密堆积的结构。在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为_____________,若该晶胞的边长为a pm,则合金的密度为___________ g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
(化学一物质结构与性质,13分)铜及其化合物在现代生活中应用广泛。
(1)用黄铜矿炼铜的最后一步反应为: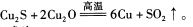
①硫元素的基态原子核外电子排布式为__________________。
②铜元素的电离能: ___________
___________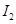 (填“>"或“<")。
(填“>"或“<")。
③反应中形成的化学键类型为_________________。
(2)硫酸铜与有机物X按1:2反应生成配合物M,其配离子结构如图。
已知A为第二周期元素。
①配合物M的晶体类型为________________。
②构成配离子的元素中,有两种元素基态原子未成对电子数相同,这两种元素的电负性从大到小的顺序是_______________(填元素符号)。
③1 mo1有机物X中含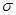 键的数目为________________。
键的数目为________________。
(3)Cu2+在生成[Cu(NH3)4]2+时,核外3d轨道上的1个未成对电子跃迁到4p轨道上,则Cu2+的轨道杂化方式不是sp3的原因是________________________。
(选考)A.[物质结构与性质]
2010年诺贝尔物理学奖授予英国曼彻斯特大学科学家安德烈·海姆和康斯坦丁·诺沃肖洛夫。共同工作多年的二人因“突破性地”用撕裂的方法成功获得超薄材料石墨烯而获奖。制备石墨烯方法有石墨剥离法、化学气相沉积法等。石墨烯的球棍模型示意图如下:
(1)下列有关石墨烯说法正确的是 ;
A.石墨烯的结构与金刚石相似
B.石墨烯分子中所有原子可以处于同一平面
C.12g石墨烯含 键数为NA
键数为NA
D.从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力
(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜、钴等金属或合金,含碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合。
①钴原子在基态时,核外电子排布式为 __________;
②乙醇沸点比氯乙烷高,主要原因是______________________ ;
③金与铜可形成的金属互化物合金(如图), 它的化学式可表示为 ;
它的化学式可表示为 ;
④下列分子属于非极性分子的是 ;
a.甲烷 b.乙炔 c.苯 d.乙醇
⑤酞菁与酞菁铜染料分子结构如图,酞菁分子中氮原子采用的杂化方式是 ;酞菁铜分子中心原子的配位数为 。
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大。其中A、C原子的L层有2个未成对电子。D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构。F3+离子M层3d轨道电子为半满状态。请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)F元素的电子排布式为 ,A、B、C的第一电离能由小到大的顺序为 。
(2)A的氢化物的分子空间构型是 ,其中心原子采取 杂化,
属于 (填“极性分子”和“非极性分子”)。
(3)F和M(质子数为25)两元素的部分电离能数据列于下表:
| 元 素 |
M |
F |
|
| 电离能 (kJ·mol-1) |
I1 |
717 |
759 |
| I2 |
1509 |
1561 |
|
| I3 |
3248 |
2957 |
比较两元素的I2、I3可知,气态M2+再失去一个电子比气态F2+再失去一个电子难。对此,你的解释 ;
(4)晶体熔点:DC EC(填“<、=、>”),原因是 。
(5)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
| |
熔点/K |
沸点/K |
标准状况时在水中的溶解度 |
| H2S |
187 |
202 |
2.6 |
| H2C2 |
272 |
423 |
以任意比互溶 |
H2S和H2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因 。
过渡金属元素及其化合物的应用广泛,是科学家们进行前沿研究的方向之一。
(1)测定土壤中铁的含量时需先将三价铁还原为二价铁,再采用邻啡罗啉做显色剂,用比色法测定,若土壤中含有高氯酸盐时会对测定有干扰。相关的反应如下:
4FeCl3+2NH2OH•HCl=4FeCl2+N2O↑+6HCl+H2O
①基态Fe原子中,电子占有的最高能层符号为__________,核外未成对电子数为__________,Fe3+在基态时,外围电子排布图为______________________________。
②羟胺中(NH2OH)采用sp3杂化的原子有_______________,三种元素电负性由大到小的顺序为________;与ClO4-互为等电子体的分子的化学式为_______________________。
(2) 过渡金属原子可以与CO分子形成配合物,配合物价电子总数符合18电子规则。如Cr可以与CO形成Cr(CO)6分子:价电子总数(18)=Cr的价电子数(6)+CO提供电子数(2×6)。Fe、Ni两种原子都能与CO形成配合物,其化学式分别为_____________、______________。
(3) Pt2+的常见配合物Pt(NH3)2Cl2存在两种不同的结构:一种为淡黄色(Q),不具有抗癌作用,在水中的溶解度较小;另一种为黄绿色(P),具有抗癌作用,在水中的溶解度较大。
①Q是_________________分子(选填“极性”或“非极性”)。
②P分子的结构简式为__________________________。
(4)NiXO晶体晶胞结构为NaCl型,由于晶体缺陷,x值为0.88,晶胞边长为a pm。晶胞中两个Ni原子之间的最短距离为___________pm。若晶体中的Ni分别为Ni2+、Ni3+,此晶体中Ni2﹢与Ni3﹢的最简整数比为_________。
(1、2、3班必做)已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E的+1价阳离子的核外有3层电子且各层均处于全满状态。
(1)E元素基态原子的核外电子排布式为___________________。
(2)B、C、D三种元素的第一电离能由小到大的顺序为_______(用元素符号表示)。
(3)B2A4是石油炼制的重要产物之一。B2A4分子中B原子轨道的杂化类型为________;1 mol B2A2分子中含________mol σ键。
(4)已知D、E能形成晶胞结构如图所示的两种化合物,则化学式:甲为______,乙为______;高温时,甲易转化为乙的原因为______________________________。
[化学-物质结构与性质]碳、氮、氧、铁、铜是常见的几种元素,请回答以下问题:
(1)已知碳、氧、氯三种元素可形成CCl4、ClO:等物质,则C,O、Cl的电负性从大到小的顺序为______。
(2)基态铜原子的核外电子排布式为___________________________。
(3)三氯化铁常温下为固体,熔点282~C,沸点315~C,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁的晶体类型为_________。
(4)lmolCH3COOH分子中含有ɑ键数目为___________。
(5)维生素B1可作为辅酶参与糖的代谢,并有保护神经系统的作用。该物质的结构式为
①维生素B1中碳原子的杂化轨道类型有__________________
②维生素B1晶体溶于水的过程中要克服的微粒间的作用力有________________。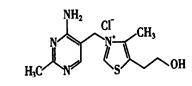
| A.离子键、共价键 | B.离子键、氢键、共价键 |
| C.氢键、范德华力 | D.离子键、氢键、范德华力 |
(6)通常酸式盐在水中的溶解度大于正盐,但NaHCO3,的溶解度却小于Na2C03,这是由于____________。
A、B、C、D、E、F、G七种前四周期元素且原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍,G2+的3d轨道有9个电子,请回答下列问题:
(1)F的基态原子电子排布式为 。
(2)B、C、D的原子的第一电离能由小到大的顺序为 (用元素符号回答)
(3)下列关于B2A2分子和A2D2分子的说法正确的是 。
a.分子中都含有σ键和π键
b.B2A2分子的沸点明显低于A2D2分子
c.都是含极性键和非极性键的非极性分子
d.互为等电子体,分子的空间构型都为直线形
e.中心原子都是sp杂化
(4)由B、E、F三种元素形成的一种具有超导性的晶体,晶胞如图所示.B位于E和F原子紧密堆积所形成的空隙当中。与一个F原子距离最近的F原子的数目为 ,该晶体的化学式为 。
(5)向GSO4(aq)中逐滴加入过量氨水,会发生先产生蓝色沉淀后沉淀消失,写出沉淀消失的离子反应方程式: 。
(6)某电池放电时的总反应为:Fe+F2O3+3H2O = Fe(OH)2+2F(OH)2(注:F2O3和F(OH)2为上面F元素对应的化合物),写出该电池放电时正极反应式 。
选考[化学一选修3:物质结构与性质]砷化稼为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。己知砷化稼的晶胞结构如图所示。请回答下列问题:
(1)下列说法正确的是____(填序号)。
| A.砷化镓晶胞结构与NaCl相同 |
| B.第一电离能As>Ga |
| C.电负性As>Ga |
| D.原子半径As>Ga |
(2)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,反应的方程式为_________________;
(3)AsH3空间形状为_______;已知(CH3)3Ga为非极性分子,则其中镓原子的杂化方式为____________;
Ⅱ.金属铜的导电性仅次于银,居金属中的第二位,大量用于电气工业。
(4)请解释金属铜能导电的原因___________,Cu2+的核外电子排布式为_________________
(5)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有___________和____________。