【化学-选修3,物质结构与性质】X、Y、Z、W都是元素周期表中的前四周期元素,它们的核电荷数依次增大。X原子的最外层p轨道的电子为半充满结构,Y是地壳中含量最多的元素。Z元素形成的一种化合物常用作净水剂。W元素是第四周期元素中未成对电子数最多的元素,WCl3能与X、Y的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,1mol配合物与足量的AgNO3溶液反应能生成3molAgCl。请回答下列问题:
(1)XH3可作低温溶剂,它易液化的原因是 ,Y所在周期中第一电离能最大的主族元素是 。
(2)XY3-离子的立体构型是 ,其中心原子采取 杂化。
(3)W3+的核外电子排布式是 ,WCl3形成的六配位的配合物化学式为 。
(4)某种Z—Fe合金的晶胞如图所示,该合金的化学式为 。若晶胞的边长为a nm,则合金的密度为 g·cm-3。
A、B、C、D、E、F、G、H八种前四周期元素,原子序数依次增大,化合物甲由A、D、E三种元素组成,常温下0.1mol/L甲溶液的pH=13;B、F同主族,F是重要的半导体材料。G为前四周期单电子数最多的元素,H最外层电子数与G相同。
(1)G的元素符号是_________原子的价电子排布图为______________
(2)短周期元素I与F性质相似,晶体类型相同,基本单元如图所示,可表示为I12,则其基本结构中含有正三角形的个数为____________
(3)C与其同族相邻元素J所形成的简单气态氢化物键角大小关系_______________(用 化学式表示)原因_____________________________
(4)B与D两元素组成的常见无机粒子中,其空间构型可能是 (填写序号)。
a.直线型 b.平面三角形 c.三角锥形 d.正四面体
(5)H原子晶体堆积模型为________________,若其密度为ρg/cm3 阿伏伽德罗常数为NA,求最近两个H原子间的距离为_________________pm(列出计算式)
[物质结构]X、Y、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体;Z基态原子的M层与K层电子数相等;R2+的3d轨道有9个电子。
请回答下列问题:
(1)Y基态原子的电子排布式是 ;
(2)Z所在周期中第一电离能最大的主族元素是 。
(3)XY2—的立体构型是 ;
(4)Z与某元素形成的化合物的晶胞如图所示,晶胞中阴离子与阳离子的个数比是 。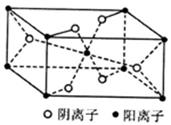
(5)将R单质的粉末加入X气态氢化物的浓溶液中,不断鼓入空气充分反应,得到深蓝色的[R(NH3)4](OH)2溶液,该反应的离子方程式是 ;1mol [R(NH3)4]2+中含有的σ键的数目是 。
C、N、Si、Fe等元素及其化合物有重要的应用。
(1)上述四种元素的原子中,未成对电子数最多的元素是_________________。
(2)C元素是形成有机物的主要元素,下列分子中含有sp和sp3杂化方式的是__________(填写序号)。
(3)继C60之后,科学家又合成了Si60、N60。C、Si、N原子电负性由大到小的顺序是____________(用元素符号表示)。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为____________。
(4)一定条件下,C元素可形成多种晶体。图1是其中某种晶体的一个晶胞,该晶胞中含有___________个C原子。
(5)图2为金属铁某种晶体的晶胞结构,已知该晶体的密度为a g/cm3为阿伏加德罗常数的值,则该晶胞的体积为_________cm3.
A、B、C、D、E、F、G、H、I是元素周期表前四周期的元素,它们在元素周期中的位置如下图所示:
(1)B、C、D三种元素的第一电离能由大到小的顺序为 (用元素符号表示);
(2)有下列物质①CA3 ②GA3 ③EH ④JH ⑤FD2。请将这些物质的熔点由高到低排列 (填这些物质的序号),其中CA3、GA3在常温、常压下都是气体,但CA3比GA3易液化,其主要原因是 。
(3)2007年诺贝尔化学奖获得者Gerhard Ertl利用光电子能谱证实:洁净L(可用于合成氨反应的催化剂)的表面上存在C原子,右图为C原子在L的晶面上的单层附着局部示意图(图中小黑色球代表C原子,灰色球代表L原子)。则在图示状况下,L颗粒表面上L/C原子数之比为 。
(4)A、B、C三种元素形成的一种化合物叫三聚氰胺(结构如图),由于其含氮量高被不法奶农添加到牛奶中来“提高”蛋白质的含量,造成全国许多婴幼儿因食用这种奶粉而患肾结石。三聚氰胺中二种环境的N原子的杂化形式分别是 。
(5)M单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示。 
请回答:晶胞中M原子的堆积方式为 ,配位数为 。
A、B、C、D、E为前四周期元素,原子序数依次增大。基态A原子的核外电子占据4个原子轨道;B与C同主族,大气平流层中单质B3浓度减少会致人患皮肤癌增加;D是前四周期元素中第一电离能最小的元素;E的合金是当今用量最大的合金。
(1)E在同期表中的位置是 ,其基态原子的简化电子排布式为 。
(2)CB 的立体构型是 。
的立体构型是 。
(3)D2C的晶胞结构与CaF2晶胞(如图)相似,则Y应为 (填离子符号);D2C的熔点比CaF2熔点 (填“高”、“低”或“无法比较”)。
A-E是周期表中1一36号的元素,它们的原子序数依次递增且分别位于前四周期的各个周期中。对它们的性质及结构的描述如下。
A原子的基态只有一种形状的电子云,并容易形成共价键;B原子的最外电子层的电子排布可表示为nsnnpn,其元素最高正化合价与最低负化合价的代数和为0;C与B同周期,其第一电离能髙于周期表中与之相邻的所有元素;D元素在周期表中位于C元素的下一周期,其电负性在同周期元素中最大;E原子最外电子层只有未成对电子,其内层所有轨道全部充满,但并不是第IA族元素。
(1)请写出E原子基态的电子排布式____________。
(2)A与C形成的最简单化合物(甲)分子的立体结构是____________,其中C原子的杂化方式是______
(3)A与D元素形成的化合物(乙)与甲相比,沸点较低的是(写化学式)____________原因是________________________
(4)B元素可形成B70单质,它在一定条件下吸收可见光后可高效杀灭癌细胞,有望成为癌症治疗药物的候选材料。它与金属钾掺杂在一起的化合物,其晶胞如图所示(白球位于立方体的体心和顶点,小黑球位于立方体的面上),则该化合物中B70与钾原子个数比为______。
原子序数依次增大的五种元素A、B、C、D、E位于周期表的前四周期。A基态原子的2p轨道上有2个未成对电子;C的最外层电子数是次外层电子数的3倍,C与D同主族相邻;E位于周期表的ds区,最外层只有一对成对电子。请回答下列问题:
(1)A、B、C三种元素第一电离能最大的是(填元素符号)______,基态E原子的电子排布式为______。
(2)C、D的简单氢化物中沸点较高的是__________(填分子式),原因是____________。
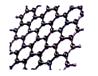
(3)A元素可形成多种单质,其中分子晶体的分子式为______________,原子晶体的名称是 ;A的一种单质为层状结构的晶体(如图),其原子的杂化轨道类型为______________。
(4)①化合物DC2的立体构型为______________,中心原子的价层电子对数为 。
②用KMn04酸性溶液吸收DC2气体时,MnO4-被还原为Mn2+,该反应的离子方程式为______________。
(5)D与E能形成化合物X,X的一种晶体晶胞结构如图所示,X的化学式为 ,E的配位数为________________;若晶胞边长为a,则晶体E的密度计算式为ρ= 。

1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献。

 (1)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
(1)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
| 晶体 |
NaCl |
KCl |
CaO |
| 晶格能/(kJ·mol-1) |
786 |
715 |
3401 |
四种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是 ,Na、Mg、Al第一电离能I1从小到大的排列顺序是 。
 (2)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示。
(2)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示。


①实验证明,用蒸汽密度法测得的H2O的相对分子质量比用化学式计算出来的相对分子质量要大,其原因是 。
 ②SO42-中S原子的杂化类型是 ,与其互为等电子体的分子有 (任写一种)
②SO42-中S原子的杂化类型是 ,与其互为等电子体的分子有 (任写一种)
 ③Cu2+还能与NH3、Cl-等形成配位数为4的配合物,[Cu(NH3)4]2+中存在的化学键类型有 (填序号)。
③Cu2+还能与NH3、Cl-等形成配位数为4的配合物,[Cu(NH3)4]2+中存在的化学键类型有 (填序号)。
A.配位键 B.离子键 C.极性共价键 D.非极性共价键
 ④写出基态Cu原子的外围电子排布式 ;
④写出基态Cu原子的外围电子排布式 ;
金属铜采用面心立方堆积方式,已知Cu原子的半径为r pm,相对原子质量为M,NA表示阿伏加德罗常数,则金属铜的密度是 g/cm3(列出计算式)。
[化学—选修3物质结构与性质】(巧分)已知A, B、C、D, E, F为元素周期表前四周期原子序数依次增大的六种元素,其中A的一种同位素原子中无中子,B的一种核素在考古时常用来鉴定一些文物的年代,D与E同主族,且E的原子序数是D的2倍,F元素在地壳中的含量位于金属元素的第二位。试回答下列问题:
(l)F元素的价层电子排布式为 。
(2)关于B2A2的下列说法中正确的是 (填选项序号)。
①B2A2中的所有原子都满足8电子稳定结构
②B2A2是由极性键和非极性键构形成的非极性分子
③每个B2A2分子中 键和
键和 键数目比为1:1
键数目比为1:1
④B2A2分子中的A-B键属于 键
键
(3)B,C,D三种元素第一电离能按由大到小的顺序排列为 (用元素符号表示) B、C、D三种元素中与BD2互为等电子体的分子式为 (用元素符号表示)
(4)A2E分子中心原子的杂化类型为_____。比较A2D与A2E分子的沸点,其中沸点较高的原因为 。元素D可形成两种同素异形体,其中在水中溶解度更大的是 (填分子式)。
(5) F单质的晶体在不同温度下有两种堆积方式,信息如下:
则方式I与方式II中F原子配位数之比为 ,晶体密度之比为 。
已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素。其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外价电子数与B相同,其余各层均充满。B、E两元素组成化合物B2E的晶体为离子晶体。C、F的原子均有三个能层,C原子的第一至第四电离能(KJ·mol-1)分别为578、1817、2745、11575;C与F能形成原子数目比为1∶3、熔点为190 ℃的化合物Q。
(1)B的单质晶体为体心立方堆积模型,其配位数为____________;E元素的最高价氧化物分子的立体构型是________________。F元素原子的核外电子排布式是_______________,G的高价离子与A的简单氢化物形成的配离子的化学式为________________。
(2)试比较B、D分别与F形成的化合物的熔点高低并说明理由________________。
(3)A、G形成某种化合物的晶胞结构如图所示。若阿伏加德罗常数为NA,该化合物晶体的密度为a g·cm-3,其晶胞的边长为________ cm。
(4)在1.01×105 Pa、T1℃时,气体摩尔体积为53.4 L·mol-1,实验测得Q的气态密度为5.00 g·L-1,则此时Q的组成为________________。
(化学一物质结构与性质,13分)铜及其化合物在现代生活中应用广泛。
(1)用黄铜矿炼铜的最后一步反应为: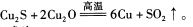
①硫元素的基态原子核外电子排布式为__________________。
②铜元素的电离能: ___________
___________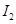 (填“>"或“<")。
(填“>"或“<")。
③反应中形成的化学键类型为_________________。
(2)硫酸铜与有机物X按1:2反应生成配合物M,其配离子结构如图。
已知A为第二周期元素。
①配合物M的晶体类型为________________。
②构成配离子的元素中,有两种元素基态原子未成对电子数相同,这两种元素的电负性从大到小的顺序是_______________(填元素符号)。
③1 mo1有机物X中含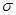 键的数目为________________。
键的数目为________________。
(3)Cu2+在生成[Cu(NH3)4]2+时,核外3d轨道上的1个未成对电子跃迁到4p轨道上,则Cu2+的轨道杂化方式不是sp3的原因是________________________。
(选考)A.[物质结构与性质]
2010年诺贝尔物理学奖授予英国曼彻斯特大学科学家安德烈·海姆和康斯坦丁·诺沃肖洛夫。共同工作多年的二人因“突破性地”用撕裂的方法成功获得超薄材料石墨烯而获奖。制备石墨烯方法有石墨剥离法、化学气相沉积法等。石墨烯的球棍模型示意图如下:
(1)下列有关石墨烯说法正确的是 ;
A.石墨烯的结构与金刚石相似
B.石墨烯分子中所有原子可以处于同一平面
C.12g石墨烯含 键数为NA
键数为NA
D.从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力
(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜、钴等金属或合金,含碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合。
①钴原子在基态时,核外电子排布式为 __________;
②乙醇沸点比氯乙烷高,主要原因是______________________ ;
③金与铜可形成的金属互化物合金(如图), 它的化学式可表示为 ;
它的化学式可表示为 ;
④下列分子属于非极性分子的是 ;
a.甲烷 b.乙炔 c.苯 d.乙醇
⑤酞菁与酞菁铜染料分子结构如图,酞菁分子中氮原子采用的杂化方式是 ;酞菁铜分子中心原子的配位数为 。
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大。其中A、C原子的L层有2个未成对电子。D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构。F3+离子M层3d轨道电子为半满状态。请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)F元素的电子排布式为 ,A、B、C的第一电离能由小到大的顺序为 。
(2)A的氢化物的分子空间构型是 ,其中心原子采取 杂化,
属于 (填“极性分子”和“非极性分子”)。
(3)F和M(质子数为25)两元素的部分电离能数据列于下表:
| 元 素 |
M |
F |
|
| 电离能 (kJ·mol-1) |
I1 |
717 |
759 |
| I2 |
1509 |
1561 |
|
| I3 |
3248 |
2957 |
比较两元素的I2、I3可知,气态M2+再失去一个电子比气态F2+再失去一个电子难。对此,你的解释 ;
(4)晶体熔点:DC EC(填“<、=、>”),原因是 。
(5)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
| |
熔点/K |
沸点/K |
标准状况时在水中的溶解度 |
| H2S |
187 |
202 |
2.6 |
| H2C2 |
272 |
423 |
以任意比互溶 |
H2S和H2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因 。
过渡金属元素及其化合物的应用广泛,是科学家们进行前沿研究的方向之一。
(1)测定土壤中铁的含量时需先将三价铁还原为二价铁,再采用邻啡罗啉做显色剂,用比色法测定,若土壤中含有高氯酸盐时会对测定有干扰。相关的反应如下:
4FeCl3+2NH2OH•HCl=4FeCl2+N2O↑+6HCl+H2O
①基态Fe原子中,电子占有的最高能层符号为__________,核外未成对电子数为__________,Fe3+在基态时,外围电子排布图为______________________________。
②羟胺中(NH2OH)采用sp3杂化的原子有_______________,三种元素电负性由大到小的顺序为________;与ClO4-互为等电子体的分子的化学式为_______________________。
(2) 过渡金属原子可以与CO分子形成配合物,配合物价电子总数符合18电子规则。如Cr可以与CO形成Cr(CO)6分子:价电子总数(18)=Cr的价电子数(6)+CO提供电子数(2×6)。Fe、Ni两种原子都能与CO形成配合物,其化学式分别为_____________、______________。
(3) Pt2+的常见配合物Pt(NH3)2Cl2存在两种不同的结构:一种为淡黄色(Q),不具有抗癌作用,在水中的溶解度较小;另一种为黄绿色(P),具有抗癌作用,在水中的溶解度较大。
①Q是_________________分子(选填“极性”或“非极性”)。
②P分子的结构简式为__________________________。
(4)NiXO晶体晶胞结构为NaCl型,由于晶体缺陷,x值为0.88,晶胞边长为a pm。晶胞中两个Ni原子之间的最短距离为___________pm。若晶体中的Ni分别为Ni2+、Ni3+,此晶体中Ni2﹢与Ni3﹢的最简整数比为_________。