过渡金属元素及其化合物的应用广泛,是科学家们进行前沿研究的方向之一。
(1)测定土壤中铁的含量时需先将三价铁还原为二价铁,再采用邻啡罗啉做显色剂,用比色法测定,若土壤中含有高氯酸盐时会对测定有干扰。相关的反应如下:
4FeCl3+2NH2OH•HCl=4FeCl2+N2O↑+6HCl+H2O
①基态Fe原子中,电子占有的最高能层符号为__________,核外未成对电子数为__________,Fe3+在基态时,外围电子排布图为______________________________。
②羟胺中(NH2OH)采用sp3杂化的原子有_______________,三种元素电负性由大到小的顺序为________;与ClO4-互为等电子体的分子的化学式为_______________________。
(2) 过渡金属原子可以与CO分子形成配合物,配合物价电子总数符合18电子规则。如Cr可以与CO形成Cr(CO)6分子:价电子总数(18)=Cr的价电子数(6)+CO提供电子数(2×6)。Fe、Ni两种原子都能与CO形成配合物,其化学式分别为_____________、______________。
(3) Pt2+的常见配合物Pt(NH3)2Cl2存在两种不同的结构:一种为淡黄色(Q),不具有抗癌作用,在水中的溶解度较小;另一种为黄绿色(P),具有抗癌作用,在水中的溶解度较大。
①Q是_________________分子(选填“极性”或“非极性”)。
②P分子的结构简式为__________________________。
(4)NiXO晶体晶胞结构为NaCl型,由于晶体缺陷,x值为0.88,晶胞边长为a pm。晶胞中两个Ni原子之间的最短距离为___________pm。若晶体中的Ni分别为Ni2+、Ni3+,此晶体中Ni2﹢与Ni3﹢的最简整数比为_________。
(1、2、3班必做)已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E的+1价阳离子的核外有3层电子且各层均处于全满状态。
(1)E元素基态原子的核外电子排布式为___________________。
(2)B、C、D三种元素的第一电离能由小到大的顺序为_______(用元素符号表示)。
(3)B2A4是石油炼制的重要产物之一。B2A4分子中B原子轨道的杂化类型为________;1 mol B2A2分子中含________mol σ键。
(4)已知D、E能形成晶胞结构如图所示的两种化合物,则化学式:甲为______,乙为______;高温时,甲易转化为乙的原因为______________________________。
[化学-物质结构与性质]碳、氮、氧、铁、铜是常见的几种元素,请回答以下问题:
(1)已知碳、氧、氯三种元素可形成CCl4、ClO:等物质,则C,O、Cl的电负性从大到小的顺序为______。
(2)基态铜原子的核外电子排布式为___________________________。
(3)三氯化铁常温下为固体,熔点282~C,沸点315~C,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁的晶体类型为_________。
(4)lmolCH3COOH分子中含有ɑ键数目为___________。
(5)维生素B1可作为辅酶参与糖的代谢,并有保护神经系统的作用。该物质的结构式为
①维生素B1中碳原子的杂化轨道类型有__________________
②维生素B1晶体溶于水的过程中要克服的微粒间的作用力有________________。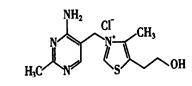
| A.离子键、共价键 | B.离子键、氢键、共价键 |
| C.氢键、范德华力 | D.离子键、氢键、范德华力 |
(6)通常酸式盐在水中的溶解度大于正盐,但NaHCO3,的溶解度却小于Na2C03,这是由于____________。
A、B、C、D、E、F、G七种前四周期元素且原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍,G2+的3d轨道有9个电子,请回答下列问题:
(1)F的基态原子电子排布式为 。
(2)B、C、D的原子的第一电离能由小到大的顺序为 (用元素符号回答)
(3)下列关于B2A2分子和A2D2分子的说法正确的是 。
a.分子中都含有σ键和π键
b.B2A2分子的沸点明显低于A2D2分子
c.都是含极性键和非极性键的非极性分子
d.互为等电子体,分子的空间构型都为直线形
e.中心原子都是sp杂化
(4)由B、E、F三种元素形成的一种具有超导性的晶体,晶胞如图所示.B位于E和F原子紧密堆积所形成的空隙当中。与一个F原子距离最近的F原子的数目为 ,该晶体的化学式为 。
(5)向GSO4(aq)中逐滴加入过量氨水,会发生先产生蓝色沉淀后沉淀消失,写出沉淀消失的离子反应方程式: 。
(6)某电池放电时的总反应为:Fe+F2O3+3H2O = Fe(OH)2+2F(OH)2(注:F2O3和F(OH)2为上面F元素对应的化合物),写出该电池放电时正极反应式 。
水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子核外电子排布图为______________________________;
(2)写出与H2O分子互为等电子体的微粒______________________(填2种);
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是___________;
| A.氧原子的杂化类型发生了改变 | B.微粒的形状发生了改变 |
| C.微粒的化学性质发生了改变 | D.微粒中的键角发生了改变 |
(4)在冰晶体中,以一个水分子为中心,画出水分子间最基本的连接方式(水分子用结构式表示);
(5)下列是钾、碘、金刚石、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是_____,D晶体的空间利用率为 。
A、B、C、D、E、F为前四周期元素且原子序数依次增大,其中A含有3个能级,且每个能 级所含的电子数相同;C的最外层有6个运动状态不同的电子;D是短周期元素中电负性最 小的元素;E的最高价氧化物的水化物酸性最强;F除最外层原子轨道处于半充满状态,其余 能层均充满电子。G元素与D元素同主族,且相差3个周期。
(1)元素A、B、C的第一电离能由小到大的是_______用元素符号表示)。
(2)E的最高价含氧酸中E的杂化方式为_______。
(3)F原子的外围电子排布式为_______,F的晶体中原子的堆积方式是下图中的_______(填写“甲”、“乙”或“丙”)。
(4)DE,GE两种晶体,都属于离子晶体,但配位数不同,其原因是_______
(5)已知DE晶体的晶胞如下图所示
若将DE晶胞中的所有E离子去掉,并将D离子全部换为A原子,再在其中的4个“小 立方体”中心各放置一个A原子,且这4个“小立方体”不相邻。位于“小立方体”中的A原 子与最近的4个A原子以单键相连,由此表示A的一种晶体的晶胞(已知A — A键的键长 为a cm, NA表示阿伏加德罗常数),则该晶胞中含有_____个A原子,该晶体的密度是_____ g/cm
(12分)下表为长式周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
(1)表中属于d区的元素是 (填编号)。写出 号元素的核外电子排布式_______________________________________;
号元素的核外电子排布式_______________________________________; 第一电离能的大小关系为________________(用元素符号表示)
第一电离能的大小关系为________________(用元素符号表示)
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如右图(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为 (用对应的元素符号表示)。
(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是 。
| A.分子中含有氢键 | B.易发生加成反应 |
| C.含有4个σ键和1个π键 | D.分子中所有原子处于同一个平面 |
(4)某元素的特征电子排布式为nsnnpn+1,该元素原子的价电子数为 ; 该元素与元素①形成的分子X在①与③形成的分子Y中的溶解度很大,其主要原因是 。
选考[化学一选修3:物质结构与性质]砷化稼为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。己知砷化稼的晶胞结构如图所示。请回答下列问题:
(1)下列说法正确的是____(填序号)。
| A.砷化镓晶胞结构与NaCl相同 |
| B.第一电离能As>Ga |
| C.电负性As>Ga |
| D.原子半径As>Ga |
(2)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,反应的方程式为_________________;
(3)AsH3空间形状为_______;已知(CH3)3Ga为非极性分子,则其中镓原子的杂化方式为____________;
Ⅱ.金属铜的导电性仅次于银,居金属中的第二位,大量用于电气工业。
(4)请解释金属铜能导电的原因___________,Cu2+的核外电子排布式为_________________
(5)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有___________和____________。
【化学——选修3:物质结构与性质】人民网2012年11月8日西宁电,青海盐湖海纳化工有限公司15万吨电石项目投产。以电石(CaC2 )为原料可生产许多重要的有机物质,电石可由CaO制得(同时还得到一种可燃性气体物质),有关转化关系如下图所示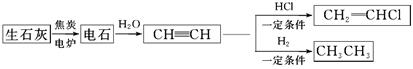
(1)写出制备电石及由电石生成乙炔的化学方程式为__________________、__________________。
(2)基态Ca2+的电子排布式为______________,上面转化关系图中涉及到的元素中,电负性最大的元素是______________,第一电离能最小的元素是________________。
(3)CH三CH、乙烷分子中的碳原子杂化类型分别为__________、______,甲烷的空间构型是________,该空间构型中,键角____(填>、<、=)109°28′。
(4)与CH2=CH2相比,CH2=CHCl属于易液化的气体,原因是___________________。
(5)假设下图是电石的晶胞,则一个晶胞中含有_____个钙离子,研究表明,哑玲形C的存在,使晶胞沿一个方向拉长,则该晶胞中一个Ca2+周围距离相等且最近的C有________个。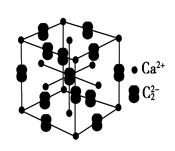
(4-5必做)根据已学知识,请你回答下列问题:
(1)最外层电子排布为4s24p1的原子的核电荷数为__________。某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,该元素的名称是_________。
(2)根据VSEPR模型,PO43-的分子立体结构为: ;乙醇易溶于水的原因是 ;HClO4的酸性强于HClO的原因是 ;
(3)三氯化铁常温下为固体,熔点282°C,沸点315°,在300°C以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为________。
(4)某元素核外有三个电子层,最外层电子数是核外电子总数的1/6,写出该元素原子的电子排布式是_____。写出铬元素在周期表中的位置________,它位于______区。
(5)如图是氯化铯晶体的晶胞示意图(晶体中最小的重复结构单元),已知晶体中2个最近的Cs+核间距为a pm,氯化铯(CsCl)的相对分子质量M,NA为阿伏加德罗常数,则氯化铯晶体的密度为 g/cm3。
[化学—选修3:物质结构与性质](15分)
Ⅰ.德国和美国科学家首先制出由20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成如图。
①C20分子中每个碳原子只跟相邻的3个碳原子形成化学键;
②多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:顶点数+面数-棱边数=2,
请回答:C20分子共有 个正五边形,共有 条棱边。
Ⅱ.A、B、C是短周期非金属元素,核电荷数依次增大。A原子外围电子排布为ns2np2,C是地壳中含量最多的元素。D元素的核电荷数为29。请用对应的元素符号或化学式填空:
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)分子(AB)2中键与键之间的夹角为180°,并有对称性,每个原子最外层电子数均满足八电子,其结构式为 ,1mol该分子中含有π键的数目为 。该分子中碳原子的杂化轨道类型是 ,该分子属于 分子(填“极性”或“非极性”)。
(3)基态D原子的电子排布式为 。
钴(Co)是一种重要的战略金属,钴及其合金广泛应用于电机、机械、化工、航空和航天等领域。钴在化合物中通常以+2、+3的形式存在。
(1)写出基态Co原子的核外电子排布式 ;
(2)Co2+、Co3+都能与CN—形成配位数为6的配离子。CN—中碳原子的杂化方式为 ;1mol HCN分子中σ键的数目为 。
(3)Co的一种氧化物的晶胞如图所示(其中黑球代表Co),则该氧化物的化学式为 在该晶体中与一个氧离子等距离且最近的Co离子所形成的空间构型为 。
(4)用KCN处理含Co2+的盐溶液,有红色的Co(CN)2析出,将它溶于过量的KCN溶液后,可生成紫色的[Co(CN)6]4—,该配离子是一种相当强的还原剂,在加热时能与水反应生成[Co(CN)6]3—,写出该反应的离子方程式 。
【化学——选修3:物质结构与性质】
Q、R、X、Y、Z为周期表中原子序数依次递增的前四周期元素。已知:
①Q为元素周期表中原子半径最小的元素;
②R的基态原子中电子占据三种能量不同的能级,且每种能级中的电子总数相同;
③Y的基态原子的核外成对电子数是未成对电子数的3倍;
④Q、R、Y三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,Q、R两种元素组成的原子个数比为1:1的化合物N的质荷比最大值为78;
⑤Z有“生物金属”之称,Z4+离子和氩原子的核外电子排布相同。
请回答下列问题(答题时,Q、R、X、Y、Z用所对应的元素符号表示)
(1)化合物M的空间构型为 ,其中心原子采取 杂化;化合物N在固态时的晶体类型为 。
(2)R、X、Y三种元素的第一电离能由小到大的顺序为 。
(3)由上述一种或多种元素组成的与RY2互为等电子体的分子为 (写分子式)。
(4)Z原子基态时的外围电子排布式为 ;Z的一种含氧酸钡盐的晶胞结构如图所示,晶体内与每个Z原子等距离且最近的氧原子数为 。
(5)由R、X、Y三种元素组成的RXY-离子在酸性条件下可与NaClO溶液反应,生成X2、RY2等物质。该反应的离子方程式为 。
已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A。其结构如图:
(1)Cu元素基态原子的外围电子排布式为_________。
(2)请在图中画出A中的配位键(用→表示)
(3)A中碳原子的轨道杂化类型为_________
(4)1mol氨基乙酸钠(H2N-CH2-COONa)含有σ键的数目为_________
(5)氨基乙酸钠分解产物之一为二氧化碳。写出二氧化碳的一种等电子体:____________(写化学式)。
(6)已知:硫酸铜灼烧可以生成一种红色晶体,其结构如图,
则该化合物的化学式是_________。
过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(SCN)3等。
(1)Fe基态核外电子排布式为 。
(2)科学研究表明用TiO2作光催化剂可将废水中CN-转化为OCN-、并最终氧化为N2、CO2。OCN-中三种元素的第一电离能由大到小的顺序为 。
(3)与OCN-互为等电子体的一种分子为 (填化学式)
(4)铁元素还能与一些氨基酸形成配合物,羧基中碳原子的杂化类型是 ;1mol乙酸中含有σ键的数目为 。
(5)铁铝合金的一种晶体属于面心立方结构,其晶胞可看成由8个小体心立方结构堆砌而成。已知小立方体如图所示。该合金的化学式为 。
