[湖北]2013届湖北省黄冈市高三上学期期末考试理综化学试卷
下列说法正确的是
| A.SO2 可用于杀菌消毒 |
| B.棉,麻,羊毛及合成纤维完全燃烧都只生成CO2和H2O |
| C.粒子直径在10-9-10-7 cm的分散系为胶体 |
| D.植物油的主要成分是高级脂肪酸 |
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.等物质的量的N2和CO所含分子数均为NA |
| B.标准状况下,11.2 L氟化氢所含的分子数为0.5NA |
| C.常温下,5.6g铁钉与足量浓硝酸反应,转移的电子数为0.5NA |
| D.常温常压下,14.9g KCl与NaClO的混合物中含氯元素的质量为7.1g |
氢镍电池是可充电电池,总反应式是H2+2NiO(OH) 2Ni(OH)2。根据此反应式,下列 有关说法中正确的是:
2Ni(OH)2。根据此反应式,下列 有关说法中正确的是:
A.该电池所用的电解质溶液为酸性溶液
B电池充电时,氢元素被还原
C.电池放电时,镍元素被氧化
D.该电池的负极反应为H2-2e-=2H+
醋酸溶液中存在电离平衡CH3COOH H++CH3COO-,下列叙述不正确的是
H++CH3COO-,下列叙述不正确的是
| A.醋酸溶液中离子浓度的关系满足:c(H+)=c(CH3COO-)+c(OH-) |
| B.物质的量浓度相等CH3COOH和CH3COONa混合溶液: c(CH3COO-)-c(CH3COOH)=2 c(H+)-2 c(OH-) |
C.CH3COOH溶液加水稀释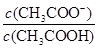 不变 不变 |
D.CH3COOH溶液加水稀释,溶液中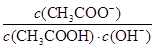 不变 不变 |
已知:R-OH+R-OH R-O-R(醚)+H2O,分子式为C2H6O和C3H8O醇的混合物在一定条件下脱水形成的醚最多有
R-O-R(醚)+H2O,分子式为C2H6O和C3H8O醇的混合物在一定条件下脱水形成的醚最多有
| A.4种 | B.5种 | C.6种 | D.7种 |
工业生产中常用MnS作为沉淀剂除去工业废水中Cu2+:Cu2+(aq)+MnS(s)=CuS(s)+Mn2+(aq),下列说法错误的是
| A.该反应达平衡时c(Mn2+)=c(Cu2+) |
| B.MnS的Ksp比CuS的Ksp大 |
| C.往平衡体系中加人少量CuSO4固体后,c(Mn2+)变大 |
D.该反应的平衡常数K=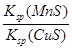 |
短周期元素X、Y、Z和W的原子序数依次增大,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是Z元素形成的单质。已知:甲+乙→丁 +己,甲+丙→戊+己;0.1mol •l-1 丁溶液的pH为13(250C)。下列说法正确的是:
A.原子半径:W>Z>Y>X
B.Y元素在周期表中的位置为第三周期第IVA族
C.X元素与Y元素形成的原子个数比为1:1的化合物有多种
D.1.0L 0.1mol •l-1戊溶液中阴离子总物质的量小于0.1 mol
煤的气化是高效、清洁地利用煤炭的重要途径之一。
(1)在250C 101kPa时,H2与O2化合生成1mol H2O(g)放出241.8kJ的热量,其热化学方程式为
___________
又知: ①C(s)+O2(g)═CO2(g) △H=-393.5kJ/mol
②CO(g)+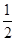 O2(g)═CO2(g) △H=-283.0kJ/mol
O2(g)═CO2(g) △H=-283.0kJ/mol
焦炭与水蒸气反应是将固体煤变为气体燃料的方法,C(s)+H2O(g)═CO(g)+H2(g) △H=____kJ/mol
(2) CO可以与H2O(g)进一步发生反应: CO(g)+H2O(g) CO2(g)+H2(g) △H<0在恒容密闭容器中,起始时n(H2O)=0.20mol,n(CO)=0.10 mol,在8000C时达到平衡状态,K=1.0,则平衡时,容器中CO的转化率是_____________(计算结果保留一位小数)。
CO2(g)+H2(g) △H<0在恒容密闭容器中,起始时n(H2O)=0.20mol,n(CO)=0.10 mol,在8000C时达到平衡状态,K=1.0,则平衡时,容器中CO的转化率是_____________(计算结果保留一位小数)。
(3) 工业上从煤气化后的混合物中分离出H2,进行氨的合成,已知反应反应N2(g)+3H2(g 2NH3(g)(△H<0)在等容条件下进行,改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:
2NH3(g)(△H<0)在等容条件下进行,改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示: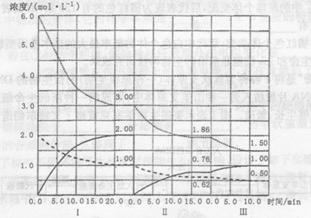
①N2的平均反应速率v1(N2)、vII(N2)、vIII(N2)从大到小排列次序为________;
②由第一次平衡到第二次平衡,平衡移动的方向 是________,采取的措施是________。
③比较第II阶段反应温度(T2)和第III阶段反应速度(T3)的高低:T2________T3填“〉、=、<”判断的理由是________________。
(13分)已知:正盐A强热可得到B、C、D、E四种物质,B通常情况下为无色无味液体,E、F 是空气主要成分,D能产生酸雨,I为红棕色气体,C与J反应可得A,J、K为两种常见的酸。物质之间的转化关系如图所示(图中部分反应物或生成物及反应条件未列出)。 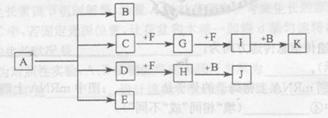
请回答下列问题:
(1)E物质的电子式是________。
(2)检验C的试纸是________,检验D的试剂是________(填试纸、试剂名称)。
(3)写出A强热分解生成B、C、D、E的化学方程式________。
(4)写出D通人FeCl3溶液时,发生反应的离子方程式_____ 。
(5) —定浓度J、K混合后的稀溶液200mL,平均分成两份。向其中一份中逐渐加人铜粉,最多能溶解a g(产生气体只为G)。向另一份中逐渐加人铁粉,产生气体的量随铁粉质量增加的变化如图所示。则①a=________g,②气体G标准状况下体积为________,③J的物质的量浓度为______。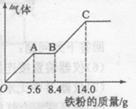
某实验小组为研究草酸的制取和草酸的性质,进行如下实验。
实验I:制备草酸
实验室用硝酸氧化淀粉水解液制备草酸的装置如图所示(加热、搅拌和仪器固定装置均已略去),实验过程如下:
①将一定量的淀粉水解液加人三颈瓶中
②控制反应液温度在55〜600C条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸 (65%HNO3与98%H2S04的质量比为2 :1.5)溶液
③反应3h左右,冷却,抽滤后再重结晶得草酸晶体。
硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2↑+8NO↑+10H2O
3 H2C2O4+2HNO3→6CO2↑+2NO↑+4H2O
(1)检验淀粉是否水解完全所需用的试剂为________。
(2)实验中若混酸滴加过快,将导致草酸产率下降,其原因是________。
实验II:草酸晶体中结晶水测定
草酸晶体的化学式可表示为H2C2O4• xH2O,为测定x的值,进行下列实验:
①称取6.3g某草酸晶体配成100.0mL的水溶液。
②取25.00mL所配溶液置于锥形瓶中,加入适量稀H2SO4,用浓度为0. 5mol/L的KMnO4溶液滴定,滴定终点时消耗KMnO4的体积为10.00mL。回答下列问题:
(3)写出上述反应的离子方程式________________。
(4)计算x=________。
(5)滴定时,常发现反应速率开始很慢,后来逐渐加快,可能的原因是________。
实验III:草酸不稳定性
查阅资料:草酸晶体(H2C2O4 •xH20),1000C开始失水,100.5℃左右分解产生H2O、CO和CO2。请用下图中提供的仪器及试剂,设计一个实验,证明草酸晶体分解得到的混合气中有H2O、CO和CO2 (加热装置和导管等在图中略去,部分装置可重复使用)。
回答下列问题:
(6)仪器装置按连接顺序为________。
(7)仪器B中无水硫酸铜的作用________。
(8)能证明混合气中含有CO的实验依据是________。
以黄铁矿(主要成分是FeS2)为原料生产硫酸的工艺流程图如下: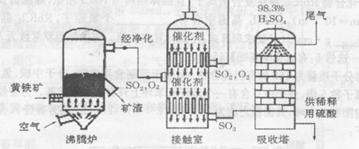
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在______的郊区(填标号)
A.有丰富黄铁矿资源的城市 B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市 D.人口稠密的文化、商业中心城市
(2)沸腾炉中发生反应的化学方程式为_____,接触室中发生反应的化学方程式是_____。
(3) 在硫酸工业制法中,下列生产操作与说明生产操作的主要原因二者都正确的是_____。
A. 硫铁矿燃烧前要粉碎,因为大块的黄铁矿不能在空气中反应
B. 从沸腾炉出来的气体要净化,因为炉气中的SO2会与杂质反应
C. SO2氧化成SO3要用催化剂,这样可提高SO2的转化率
D. SO3用98. 3%的浓硫酸来吸收,目的是为了防止形成酸雾,以提髙SO3吸收效率
(4) 下表是压强对SO2平衡转化率的影响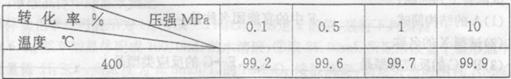
对于SO2转化SO3的反应,增大压强可使转化率______________,但在实际工业生产中常采用常压条件,理由是________________________________。
(5)某工厂用500t含硫量为48%的黄铁矿制备硫酸,若在沸腾炉中有2%的FeS2损失,在接触室中SO3的产率为96%,则可得到98%的浓硫酸的质量是_____t。
卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)卤素互化物如IBr ICl等与卤素单质结构相似、性质相近。Cl2、IBr、ICl沸点由髙到低的顺序为
_____,I和Cl相比,电负性较大的是_____。
(2)基态溴原子的电子排布式为_____,碘原子价电子的电子排布图为_____。
(3)I3+属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为______,中心I原子的杂化轨道类型为
__________。
(4)请推测①HClO4、②HIO4、③H5IO6[可写成(HO)5IO]三种物质的酸性由强到弱的顺序为_______(填序号)。
(5) 离子化合物RbICl2存在复合阴离子,且晶体结构与NaCl相似,晶胞边长为685.5pm( pm=10-12m), RbICl2晶胞中含有______个氯原子,RbICl2晶体的密度是_____g•cm3(只要求列箅式,不必计算出数值。阿伏伽德罗常数为NA)。
相对分子质量为162的有机化合物M,用于调制食用香精,分子中碳、氢原子数相等,且为氧原子数5倍,分子中只含有一个苯环且苯环上只有一个取代基。芳香烃A的核磁共振氢谱谱图有6个峰,其面积之比为1:2:2:2:1:2。用芳香烃A为原料合成M 路线如下: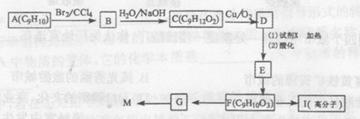
巳知: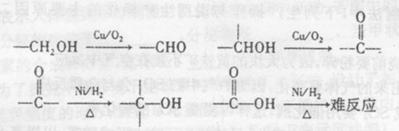
试回答下列问题:
(1)A的结构简式__________,F中的官能团名称是_____。
(2)试剂X的名称_____。
(3)B-C的反应类型是_____,F—G的反应类型是_____。
(4) 完成下列化学方程式
F→I:__________。
G→M:__________。
(5)其中F的同分异构体有多种,其中有一类可用通式如图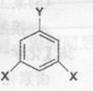 表示(其中X、Y均不为氢原子),试写出符合上述通式且能发生银镜反应的两种物质的结构简式__________。
表示(其中X、Y均不为氢原子),试写出符合上述通式且能发生银镜反应的两种物质的结构简式__________。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号