(1)若用食用油炒咸菜的铁锅如果没有洗净,不久会出现红褐色锈斑。则铁锅的锈蚀属于 腐蚀(填“析氢”或“吸氧”);该腐蚀正极的电极反应式为 ;此反应每转移2mol电子消耗的O2在标准状况下的体积为 L。
(2)某同学用碳棒、铜棒和稀硫酸为原材料,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)=CuSO4+H2↑。请在下边方框中画出能够实验这一反应的装置图(作必要的标注);某同学做该实验时,看到
碳棒上有气泡产生,铜棒上气泡更多且没有被腐蚀,其原因是 。
研究CO2的利用对促进低碳社会的构建具有重要的意义。
(I)将CO2与焦炭作用生成CO,CO可用于炼铁等。
①已知:Fe2O3(s) + 3C(石墨) =2Fe(s) + 3CO(g) △H 1 =+489 kJ·mol-1
C(石墨) +CO2 (g) =2CO(g) △H 2 = +172 kJ·mol-1
则Fe2O3(s) + 3CO(g) = 2Fe (s) + 3CO2(g) △H= 。
②利用燃烧反应可设计成CO/O2燃料电池(以H2SO4溶液为 电解质溶液),写出该电池的正极反式 。
(II)如图所示,烧杯中都盛有稀硫酸。
(1)中反应的离子方程式为 ;比较(1)、(2)、(3)中纯铁被腐蚀的速率由快到慢的顺序是 (用序号表示) 。
能量之间可相互转化:
(1)电解食盐水制备Cl2是将电能转化为化学能,而原电池可将化学能转化为电能。设计两种类型的原电池,探究其能量转化效率。限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线。
①完成原电池甲的装置示意图(见上图),并作相应标注,要求:在同一烧杯中,电极与溶液含相同的金属元素。
②以铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极__________。
③甲乙两种原电池可更有效地将化学能转化为电能的是________,其原因是______________________________。
(2)根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在(1)的材料中应选__________作阳极。
写出下列反应的热化学方程式或电极反应式:
(1)N2(g)与H2(g)反应生成1molNH3(g),放出46.1kJ热量 。
(2)钢铁发生吸氧腐蚀时的正极电极反应式 。
(3)CH4与O2在酸性条件下形成原电池时,负极的电极反应式 。
(12分)铁在地壳中的含量约占 5 %左右。铁矿石的种类很多,重要的有磁铁矿石(主要成分是Fe3O4)、赤铁矿石(主要成分是 Fe2O3)等。
(1)红热的铁能跟水蒸气反应,一种产物与磁铁矿的主要成分相同,另一种产物是可燃性气体,则其反应的化学方程式为 。该可燃气体在酸性条件下,可制成燃料电池,写出该气体发生的电极反应式 。
(2)在常温下,铁跟水不起反应。但在潮湿的空气中,铁很容易生锈(铁锈的主要成分是 Fe2O3)而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。铁生锈的化学原理如下,请你用离子方程式和化学方程式补充完整。
①原电池反应:
负极:2Fe-4e-=2Fe2+、正极: ;
②氢氧化物的形成: Fe2 + + 2OH-= Fe(OH)2↓ 。
③氢氧化物的分解: 2Fe(OH)3 =Fe2O3+3H2O。
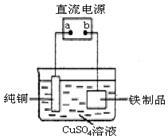
(3)为了防止铁生锈,可在铁制品表面镀上一层铜(如图装置),a为 (填“正极”或“负极”),铁制品表面发生的电极反应式 为 。
24.(15分)本题为选做题,包括A、B两题。选学《化学与生活》模块的考生答A题,选学《有机化学基础》模块的考生答B题,每位考生只可选做1题。若两题都作答,则以A题计分。
A.《化学与生活》
(4分)性能各异的各种材料的广泛应用大大提高了人们的生活水平。回答问题:
(1)家庭中“钢精锅”是由铝合金做成的,在烧菜时能否放大量醋炖煮? 。(填能或否)
(2)下列关于铁制品保护措施的说法中不正确的有 (填序号)。
A.在自行车钢圈上镀上一层金属铬,摩擦部位加上机油或黄油
B.相同条件下,马口铁(表层镀锡)与白铁(表层镀锌)相比,马口铁更为耐用
C.在海轮的外壳上常焊有锌块,且定期更新
D.将不锈钢制成刀具和餐具,有的刀具还进行烤蓝处理
(3)在快中子反应堆中得以广泛应用的钠钾合金,这个事实说明合金的熔点比其成分金属的熔点 (填字母)。
a.高 b.低 c.可能高也可能低
(4)轨道交通建设需要大量金属材料。下列金属材料最容易发生腐蚀的是 (填字母)
a、铝合金 b、钢铁 c、纯度很高的铁
下列四个装置图均与电化学有关,请根据图示回答相关问题:
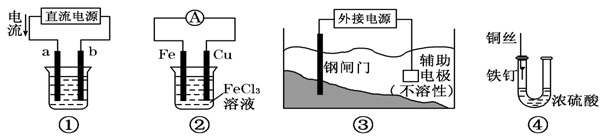
(1)这四个装置中,利用电解原理的是 (填装置序号);
(2)装置①若用来精炼铜,则a极的电极材料是 (填“粗铜”或“精铜”),电解质溶液为 ;
(3)装置②的总反应方程式是 ;
(4)装置③中钢闸门应与外接电源的 极相连(填“正”或“负”)
(5)装置④中的铁钉几乎没被腐蚀,其原因是 。
(9分) 观察下列几个装置示意图,有关叙述正确的是
(1)在①图中,发生反应的化学方程式为: 。
(2)在②图中,待镀铁制品应与电源 极相连,电极反应式为: 。
(3)在③图中,外电路电子由 极流向 极,若电解液为KOH溶液,则b极的反应式为 。
(16分)对金属制品进行抗腐蚀处理,可延长其使用寿命。
(1)以下为铝材表面处理的一种方法:
①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时候常有气泡冒出,原因是 (用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的 。
a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4溶液中电解,电解后取少量废电解液,加入NaHCO3,溶液后产生气泡和白色沉淀,产生沉淀的原因是 (用离子方程式表示)
(2)镀铜可防止铁制品腐蚀,电镀时用 来做阳极。
(3)利用如图装置,可以模拟铁的电化学防护。
若X为碳棒,为减缓铁的腐蚀,开关K应放于 处,写出X极的电极反应
若X为碳棒,开关K置于M处,写出X极的电极反应
某研究性学习小组探究金属锈蚀的条件,进行如下对照实验:
(1)数天后铁钉明显锈蚀的装置是 ;
(2)铁制品锈蚀的条件是 ;
(3)铁钉生锈主要属于 腐蚀(填“化学”或“电化学”);
(4)写出金属防护的一种常用方法 。
铁及其化合物与生产、生活关系密切。
Ⅰ.为防止远洋轮船的钢铁船体在海水中发生电化学腐蚀,通常把船体与浸在海水里的Zn块相连,或与蓄电池这样的直流电源的 极(填“正”或“负”)相连。
II.为了探究原电池和电解池的工作原理,某研究性学习小组分别用下图所示的装置进行实验。据图回答问题。

用图甲所示装置进行第一组实验时:
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是 (填序号)。
| A.石墨 | B.镁 | C.银 | D.铂 |
(2)实验过程中,SO42− (填“从左向右”“从右向左”或“不”)移动
(3)滤纸上发生的化学方程式为: 。
III.该小组同学用图乙所示装置进行第二组实验时发现,两极均有气体产生,且Y极溶液逐渐变成紫红色:停止实验观察到铁电极明显变细,电解液仍然澄清。查阅资料知,高铁酸根(FeO42-)在溶液中呈紫红色。请根据实验现象及所查信息,回答下列问题:
(4)电解过程中,X极溶液的pH (填“增大”“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应为4OH−-4e−=2H2O+O2↑和 。
(6)电解进行一段时间后,若在X极收集到672mL气体,Y电极(铁电极)质量减小0.28g,则在Y极收集到气体为 mL(均已折算为标准状况时气体体积)。
(6分)完成下列离子反应方程式
(1)AlCl3溶液与Na2CO3溶液混合:____________;
(2)向AgCl固体上滴加Na2S溶液,固体变黑色:_________________;
(3)铁在潮湿的空气中发生电化腐蚀时,正极反应式:_________________。
(I)某学生设计了如图所示的装置(框内部分未画出),在装置内起初发生的反应为Cu+H2SO4==H2↑+CuSO4,试回答:
(1)该装置的名称是 (填“电解池”或“原电池”)。
(2)A、B中至少有一种是金属 (填名称),接电源的 (填“正极”或“负极”)。
(3)写出该装置中发生还原反应的电极反应方程式为 。
(4)若C溶液为100ml饱和食盐水,A 和B电极均为碳棒,该学生利用图示装置进行电解,写出该电解过程中的总反应的离子方程式 ,当放出标况下112ml氢气时,该溶液的PH= (室温下)。
(II)利用下图装置,可以模拟铁的电化学防护。若X为铜,为减缓铁的腐蚀,开关K应置于________处。若X为锌棒,开关K置于M处,该电化学防护法称为 。
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一。请回答钢铁在腐蚀、防护过程中的有关问题。
(1)下列哪个装置可防止铁棒被腐蚀________________。
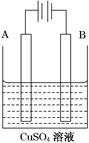
(2)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如图。请回答:
①A电极对应的金属是________(写元素名称),B电极的电极反应式是________________________。
②镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因
____________________________________________________