如图所示,水槽中试管内有一枚铁钉,放置数天观察:

(1)铁钉在逐渐生锈,则铁钉的腐蚀属于 腐蚀。
(2)若试管内液面上升,则原溶液是 性,发生 腐蚀,
电极反应:负极: ,正极: 。
(3)若试管内液面下降,则原溶液是 性,发生 腐蚀,
电极反应:负极: ,正极: 。
某研究小组对铁生锈进行研究:
(1)经过较长时间后,甲同学观察到的现象是:上图中的铁钉最容易生锈的是 (填字母)。
(2)根据实验条件判断,在铁钉的锈蚀过程中,正极的电极反应为: ;
(3)若为了防止铁钉生锈,该小组同学想在铁钉表面镀上一层金属,该金属最好是( )
A. 锡 B. 铜 C. 锌
(4)钢铁容易腐蚀,工业生产中常需对钢铁进行“发蓝”处理,以有效避免或减缓钢铁的腐蚀。所谓“发蓝”,就是在钢铁零件等进行氧化处理,使其表面形成一层致密的蓝黑色氧化膜。发蓝处理过程可表示如下: 
为检验经过步骤Ⅳ处理的铁件是否合格,常往成品表面滴上5%的硫酸铜溶液,如果成品不合格(即铁件表面有微小松孔,未形成致密的氧化膜),一段时间将观察到的现象为__________________________。
Ⅰ.用导线将A、B两装置的四个电极进行连接,使a极析出铜。回答有关问题。
(1)导线将容器A和B连接时,Zn接 ,Cu接 (填“a”或“b”)
(2)容器A中Cu极发生的电极反应为 。
(3)B装置叫 ,溶液中的NO3-向_____极移动(填“a”或“b”)。
(4)若b极观察到有无色无味气泡产生, 经过一段时间后,停止反应并搅拌均匀,溶液的pH值将 (填“升高”、“降低”或“不变”),加入一定量的 后(填化学式),溶液能恢复至与反应前完全一致。若反应一段时间后,测得溶液中Cu2+浓度没有明显下降,可能的原因是: 。
Ⅱ.炒菜的铁锅没有洗干净容易生锈。用必要的文字和有关化学方程式说明铁锈是如何形成的
。
(16分)对金属制品进行抗腐蚀处理,可延长其使用寿命。
(1)以下为铝材表面处理的一种方法:
①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时候常有气泡冒出,原因是 (用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的 。
a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4溶液中电解,电解后取少量废电解液,加入NaHCO3,溶液后产生气泡和白色沉淀,产生沉淀的原因是 (用离子方程式表示)
(2)镀铜可防止铁制品腐蚀,电镀时用 来做阳极。
(3)利用如图装置,可以模拟铁的电化学防护。
若X为碳棒,为减缓铁的腐蚀,开关K应放于 处,写出X极的电极反应
若X为碳棒,开关K置于M处,写出X极的电极反应
研究CO2的利用对促进低碳社会的构建具有重要的意义。
(I)将CO2与焦炭作用生成CO,CO可用于炼铁等。
①已知:Fe2O3(s) + 3C(石墨) =2Fe(s) + 3CO(g) △H 1 =+489 kJ·mol-1
C(石墨) +CO2 (g) =2CO(g) △H 2 = +172 kJ·mol-1
则Fe2O3(s) + 3CO(g) = 2Fe (s) + 3CO2(g) △H= 。
②利用燃烧反应可设计成CO/O2燃料电池(以H2SO4溶液为 电解质溶液),写出该电池的正极反式 。
(II)如图所示,烧杯中都盛有稀硫酸。
(1)中反应的离子方程式为 ;比较(1)、(2)、(3)中纯铁被腐蚀的速率由快到慢的顺序是 (用序号表示) 。
(1)X、Y、Z三种金属,X、Y组成原电池,X是负极;把Y放在Z的硝酸盐溶液中,Y表面有Z析出。其活泼顺序是_________________;
(2)由氢气和氧气反应生成1mol水蒸气放热241.8 kJ,写出该反应的热化学方程式:___________________________ _______。
(3)下列各情况,在其中Fe片腐蚀由快到慢的顺序是 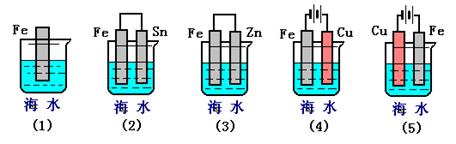
原电池是化学对人类的一项重大贡献。某兴趣小组为研究原电池原理,设计如图装置:

(1)a和b用导线连接,Cu极为原电池_________极(填“正”或“负”),电极反应式为 Zn极发生_________(填“氧化”或“还原”)反应。溶液中H+移向____________(填“Cu”或“Zn”)极。
(2)无论a和b是否连接,Zn片均被腐蚀。若转移了0.2mol电子,则理论上Zn片质量减轻______g。
(3)有同学想把Ba(OH)2•8H2O晶体与NH4Cl晶体的反应设计成原电池,你认为是否可行? (填“是”或“否”),理由是 。
(8分)钢铁很容易生锈而被腐蚀。
(1)钢铁腐蚀主要是吸氧腐蚀,吸氧腐蚀过程中的电极反应为:
负极_______________ _______________;
正极_______________________________ 。
(2)为了降低某水库的铁闸门的腐蚀速率,可以采用图甲所示的方案,其中焊接在铁闸门上的固体材料R可以采用 _________(填序号)。
| A.铜 | B.钠 | C.锌 | D.石墨 |
(3)图乙所示的方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的___________极上。
下图所示水槽中的试管内有一枚铁钉(含少量的炭),放置数天后观察:

(1)若试管内液面上升,则铁钉发生了 腐蚀,
正极反应式为 。
(2)若试管内的液面下降,则铁钉发生了 腐蚀,
负极反应式为 ,正极反应式为 。
(1)若用食用油炒咸菜的铁锅如果没有洗净,不久会出现红褐色锈斑。则铁锅的锈蚀属于 腐蚀(填“析氢”或“吸氧”);该腐蚀正极的电极反应式为 ;此反应每转移2mol电子消耗的O2在标准状况下的体积为 L。
(2)某同学用碳棒、铜棒和稀硫酸为原材料,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)=CuSO4+H2↑。请在下边方框中画出能够实验这一反应的装置图(作必要的标注);某同学做该实验时,看到
碳棒上有气泡产生,铜棒上气泡更多且没有被腐蚀,其原因是 。
合理使用材料,改善人类生活。
① 钢铁是人类生产和生活中非常重要的材料,但每年因锈蚀而损失的数量十分惊人。金属腐蚀分为化学腐蚀和电化学腐蚀,两者的微观本质都是发生 的过程。为防止轮船船体在海水中被腐蚀,一般在船身连接 (选填“锌块”或“铜块”)。
② 在普通玻璃制造过程中,碳酸钙与二氧化硅在高温下发生反应的化学方程式是
。橡胶是制造轮胎的重要原料,天然橡胶通过硫化措施,使它的分子转化为 结构,从而增大橡胶的强度。
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液跟烧碱反应制得白色纯净的Fe(OH)2沉淀,应用如图所示装置可以制得白色纯净的Fe(OH)2沉淀。两极材料分别为铁和石墨。
(1)a电极材料应为 ,电极反应式为 。
(2)电解液c最好是 (填编号)。
| A.纯水 | B.AgNO3溶液 | C.NaOH溶液 | D.CuCl2溶液 |
(3)d为苯,其作用是 ,在加入苯之前,
对c应作何简单处理? 。
Ⅰ.钢铁工业是国家工业的基础。请回答钢铁腐蚀、防护过程中的有关问题。
请写出钢铁在碱性、潮湿的环境下发生电化学腐蚀正极的电极反应式: ;
下列哪个装置示意图可防止铁棒被腐蚀 。
Ⅱ.某小组为研究电化学原理,设计如下图装置。请回答下列问题:
(1)a和b不连接时,铁片上发生反应的离子方程式为 ,此时能量转化形式主要是化学能转化为 能。
(2)a和b用导线连接时,外电路中的电子是从 电极流出(填“Fe”或“Cu”), (填Cu2+ 或SO42-)离子朝负极移动,Cu极所发生反应的电极反应式为 。
(3)现在要在铁片上镀一层金属铜,则a极要和直流电源的 (填“正极”或“负极”)连接;此时 铜片上发生的电极反应式为 。
铜片上发生的电极反应式为 。