(1)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨做阳极的原因是 。
(2)利用右装置,可以模拟铁的电化学防护。
若X为碳棒,为减缓铁的腐蚀,开关K应该置于 处。若X为锌,开关K置于M 处,该电化学防护法称为 。
处,该电化学防护法称为 。
下图所示水槽中试管内有一枚铁钉,放置数天后观察:
(1)铁钉在逐渐生锈,则铁钉的腐蚀属于 腐蚀。
(2)若试管内液面上升,则原溶液呈 性,发生 腐蚀,正极反应式为 。
(3)若试管内液面下降,则原溶液呈 性,发生 腐蚀,正极反应式为 。
(1)若用食用油炒咸菜的铁锅如果没有洗净,不久会出现红褐色锈斑。则铁锅的锈蚀属于 腐蚀(填“析氢”或“吸氧”);该腐蚀正极的电极反应式为 ;此反应每转移2mol电子消耗的O2在标准状况下的体积为 L。
(2)某同学用碳棒、铜棒和稀硫酸为原材料,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)=CuSO4+H2↑。请在下边方框中画出能够实验这一反应的装置图(作必要的标注);某同学做该实验时,看到
碳棒上有气泡产生,铜棒上气泡更多且没有被腐蚀,其原因是 。
下图所示水槽中的试管内有一枚铁钉(含少量的炭),放置数天后观察:

(1)若试管内液面上升,则铁钉发生了 腐蚀,
正极反应式为 。
(2)若试管内的液面下降,则铁钉发生了 腐蚀,
负极反应式为 ,正极反应式为 。
Ⅰ.钢铁工业是国家工业的基础。请回答钢铁腐蚀、防护过程中的有关问题。
请写出钢铁在碱性、潮湿的环境下发生电化学腐蚀正极的电极反应式: ;
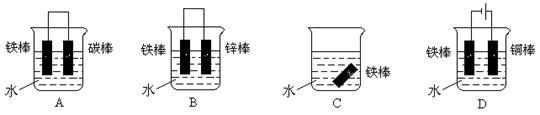
下列哪个装置示意图可防止铁棒被腐蚀 。
Ⅱ.某小组为研究电化学原理,设计如下图装置。请回答下列问题:
(1)a和b不连接时,铁片上发生反应的离子方程式为 ,此时能量转化形式主要是化学能转化为 能。
(2)a和b用导线连接时,外电路中的电子是从 电极流出(填“Fe”或“Cu”), (填Cu2+ 或SO42-)离子朝负极移动,Cu极所发生反应的电极反应式为 。
(3)现在要在铁片上镀一层金属铜,则a极要和直流电源的 (填“正极”或“负极”)连接;此时 铜片上发生的电极反应式为 。
铜片上发生的电极反应式为 。
合理使用材料,改善人类生活。
① 钢铁是人类生产和生活中非常重要的材料,但每年因锈蚀而损失的数量十分惊人。金属腐蚀分为化学腐蚀和电化学腐蚀,两者的微观本质都是发生 的过程。为防止轮船船体在海水中被腐蚀,一般在船身连接 (选填“锌块”或“铜块”)。
② 在普通玻璃制造过程中,碳酸钙与二氧化硅在高温下发生反应的化学方程式是
。橡胶是制造轮胎的重要原料,天然橡胶通过硫化措施,使它的分子转化为 结构,从而增大橡胶的强度。
下图所示装置中,甲、乙两个烧杯分别依次盛放200mL饱和食盐水、足量的AgNO3溶液,a、b、c、d四个电极均为石墨电极。接通电源,经过一段时间后,测得乙中d电极质量增加了2.16g。据此回答问题:
 (1)电源的N端为 极;
(1)电源的N端为 极;
(2)电极b上发生的电极反应为 ;
(3)电极c上生成的气体在标准状态下的体积: ;
(4)甲溶液的氢氧根离子浓度为 (设溶液体积仍为200mL);
(5)欲在丙烧杯中实现铁的表面镀上一层铜,则电解质溶液为 ,e电极的材料是: ,f电极的电极反应式为 。
金属的防腐常用方法有
| A.覆盖油漆 | B.覆 盖塑料 盖塑料 |
C.电镀金属 |
D.电化学保护法 E.制成不锈钢 E.制成不锈钢 |
请为以下钢铁制品选择一种适当的防止生锈的方法(填写序号):
(1) 邮筒___ ___ ___ (2) 手术刀_____ ___
(3) 海水中的钢闸门________ (4) 电线____ ______
(5) 自行车的钢圈____________。
铁及其化合物与生产、生活关系密切。
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
①该电化腐蚀称为 。
②图中A和B区域相比较,腐蚀较慢的是 (填字母)。
(2)实验室经常用到FeCl3溶液,在配制FeCl3溶液时常需加入少量 的 ;将FeCl3溶液和碳酸氢钠溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为 。
(3)已知t℃时,反应FeO(s)+CO(g) Fe( s) +CO2(g)的平衡常数K= 0.25。
Fe( s) +CO2(g)的平衡常数K= 0.25。
①t℃时,反应达到平衡时n(CO2):n(CO)=
②若在1L密闭容器中加人0.02 mol FeO(s),并通入x mol CO,t℃时反应达到平衡。此时
FeO(s)转化率为50%,则x= 。
某电镀铜厂有两种废水需要处理,一种废水中含有CN—离子,另一种废水中含有Cr2O2-7离子。该厂拟定如图19所示的废水处理流程。
回答以下问题:
(1)上述处理废水的流程中主要使用的方法是 。
(2)②中使用的NaCl0溶液呈碱性,用离子方程式解释原因____。
(3)②中反应后无气体放出,该反应的离子方程式为 。
(4)③中反应时,每0.4 mol Cr2O2-7转移2.4 mol e-,该反应的离子方程式为 。
(5)取少量待检水样于试管中,先加入NaOH溶液,观察到有蓝色沉淀生成,继续加入NaOH溶液,直到不再产生蓝色沉淀为止,再加入Na2S溶液,有黑色沉淀生成,且蓝色沉淀逐渐减少。请你使用化学用语,结合必要的文字解释其原因 。
装置甲、乙、丙的烧杯中都盛有稀硫酸。
(1)装置丙中的Fe电极上的反应式:____________________。
(2)装置乙中被腐蚀的金属是________________(填元素符号),比较装置甲、乙、丙中纯铁被腐蚀的速率由快到慢的顺序是_____________。
(3)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如图丁。请回答:
A电极对应的金属是____________(写元素名称),B电极的电极反应式是______________________。
镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因_____________________。
铁及其化合物与生产、生活关系密切。
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。

①该电化腐蚀称为。
②图中四个区域,生成铁锈最多的是(填字母)。
(2)用废铁皮制取铁红()的部分流程示意图如下:

①步骤I若温度过高,将导致硝酸分解。硝酸分解的化学方程式为。
②步骤Ⅱ中发生反应:,反应产生的
又将废铁皮中的铁转化为
,该反应的化学方程式为。
③上述生产流程中,能体现"绿色化学"思想的是(任写一项)。
(3)已知t℃时,反应的平衡常数
=0.25。
①t℃时,反应达到平衡时=。
②若在1 密闭容器中加入0.02
,并通入
,t℃时反应达到平衡。此时
转化率为50%,则
=。
【原创】现有A、B、C、D、E五种金属片,①把A、C用导线连接后同时浸入稀硫酸铜溶液中,A上有红色固体产生;②把C、D用导线连接后同时浸入稀硫酸溶液中,D发生氧化反应;③把A、B用导线连接后同时浸入稀硫酸溶液中,电流方向为B→导线→A;④将E放入水中,立即有气体产生。根据上述情况,回答下列问题:
(1)在①中,金属片_______发生氧化反应;
(2)在②中,金属片_______作负极;
(3)如果把B、D用导线连接后同时浸入稀硫酸溶液,则金属片_______上有气泡产生;
(4)上述五种金属的活动性顺序是__________________。
某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(1)请完成以下实验设计表(表中不要留空格):
| 编号 |
实验目的 |
碳粉/ |
铁粉/ |
醋酸/% |
| ① |
为以下实验作参照 |
0.5 |
2.0 |
90.0 |
| ② |
醋酸浓度的影响 |
0.5 |
|
36.0 |
| ③ |
0.2 |
2.0 |
90.0 |
(2)编号①实验测得容器中压强随时间变化如图2。时,容器中压强明显小于起始压强,其原因是铁发生了腐蚀,请在图3中用箭头标出发生该腐蚀时电子流动方向;此时,碳粉表面发生了("氧化"或"还原")反应,其电极反应式是。
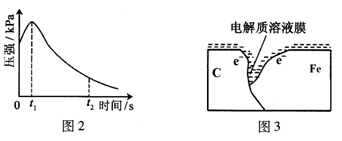
(3)该小组对图2中0~时压强变大的原因提出了如下假设,请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二:;
……
(4)为验证假设一,某同学设计了检验收集的气体中是否含有的方案。请你再设计一个实验方案验证假设一,写出实验步骤和结论。
| 实验步骤和结论(不要求写具体操作过程): |
钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程中的有关问题。
(1)工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式: 。
(2)铁在潮湿的空气中容易被腐蚀为铁锈(Fe2O3•xH2O),写出铁发生电化学腐蚀时正极的电极反应: 。
(3)下列哪个装置可防止铁棒被腐蚀 (填字母)。

(4)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置如右图,请回答:
① B电极对应的金属是 (写元素名称),A电极的电极反应式是 。
② 若电镀前两电极的质量相同,电镀完成后, 若电镀时电路中通过的电子为0.2mol,将它们取出洗净、烘干、称量,则A、B两极质量相差 g。