“烂版液”是制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含有少量的Cl-、Fe3+),某化学兴趣小组拟用“烂版液”制取Zn(NO3)2·6H2O的过程如下:

已知:Zn(NO3)2·6H2O是一种无色晶体,水溶液呈酸性,Zn(NO3)2能与碱反应,得到的产物具有两性。
生成氢氧化物沉淀的pH
| |
Fe(OH)3 |
Zn(OH)2 |
| 开始沉淀时 |
1.5 |
8.0 |
| 完全沉淀时 |
2.8 |
11.1 |
注:金属离子的起始浓度为0.1mol/L
回答下列问题:
(1)“烂版液”中溶质的主要成分是Zn(NO3)2,若稀硝酸腐蚀锌板产生的气体为N2O,写出稀硝酸腐蚀锌板反应的主要化学方程式_____________________________。
(2)在操作①中保持pH=8的目的是____________________________。
(3)沉淀Ⅰ的主要成分是_______________________________________。
(4)操作③中调节pH的范围是___________________;目的是________________。
钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程中的有关问题。
(1)工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:
_______________________________________  。
。
(2)铁在潮湿的空气中容易被腐蚀为铁锈( Fe2O3•x H2O),写出铁发生电化学腐蚀时负极的电极反应:____________________________________________ 。
Fe2O3•x H2O),写出铁发生电化学腐蚀时负极的电极反应:____________________________________________ 。
(3)生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,
溶液中发生的化合反应的离子方程式______________________________ 。
(4)下列各个装置中铁棒被腐蚀由难到易的顺序是_______________________(填字母) 。
(5)写出两种防护铁生锈的方法。
如何防止铁的锈蚀是工业上研究的重点内容。为研究铁的锈蚀,某同学做了探究实验,如下图所示,铁处于①、②、③三种不同的环境中。请回答:
(1)铁被腐蚀的速率由快到慢的顺序是 (填序号)。
(2)铁处于①环境时,正极反应式___________________________
(3)请你为以下钢铁制品选择适当的防锈方法。
A.自行车的链条、齿轮
B.海水中的轮船
(12分)
本题共有3个小题,回答有关问题:
(1)检验牙膏中含有甘油的试剂是 ,实验现象 ;有关反应的化学方程式 。
(2)在两烧杯中盛有甲、乙两种不同的稀溶液,用铁丝做电化腐蚀实验。实验进行一段时间后,A试管中液面高于烧杯中液面,B试管中液面低于烧杯中液面,试比较pH值大小:
甲 乙(填“<”、“>”或“=”),并写出A中铁丝发生腐蚀时的电极反应式:负极 ,正极 。
(3)已知某溶液中只存在 、H+、
、H+、 、Na+四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
、Na+四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
I:
II:
III:
IV:
①若溶液中只溶解了一种溶质,则该溶质是 ,上述四种离子浓度的大小顺序
为 (填编号)。
②若上述关系中III是正确的,则溶液中溶质为
③若该溶液是由体积相等的氢氧化钠溶液和醋酸溶液混合而成,且恰好呈中性,则混合前两溶液的物质的量浓度大小关系为
 (填“<”、“>”或“=”),混合前
(填“<”、“>”或“=”),混合前 溶液中的
溶液中的
 溶液中的
溶液中的 (填“<”、“>”或“=”)。
(填“<”、“>”或“=”)。
对照试验是化学研究中常用的一种方法。某研究小组对铁生锈进行如下研究。
(1)经过较长时间后发现:上述图中的铁钉最容易生锈的是 。
(2)在铁钉的锈蚀过程中,Fe发生了 (填“氧化”或“还原”)反应。
(3)铁生锈的外部条件是 。
(4)钢铁工业史国家工业的基础。下列措施能起到防腐作用的是 。
A.刷油漆 B.包上一层塑料层 C.连接一定数量镁块
(1)埋在地下的输油铁管道,在下列情况下,①在含铁元素较多的酸性土壤中、②在潮湿疏松透气的土壤中、③在干燥致密不透气的土壤中、④在含碳颗粒较多,潮湿透气的中性土壤中。被腐蚀速率最慢的是
(2)以石墨棒为两极,氯化铜溶液为电解液组成的电解池的
阴极电极反应式是
在化学反应中发生的能量转变形式是
对金属制品进行搞腐蚀处理,可延长其使用寿命。
(1)以下为铝村表面处理的一种方法:

①碱洗的目的是除去铝村表面的自然氧化膜,碱洗衣时候常有气泡冒出,原因是:(用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的。
a. b.
c.
d.
②以铝村为阳极,在溶液中电解,铝村表面形成氧化膜,阳极电极反应式为:。取少量废电解液,加入
溶液后产生气泡和白色沉淀,产生沉淀的原因是。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨做阳极的原因是。
(3)利用下图装置,可以模拟铁的电化学防护。

若为碳棒,为减缓铁的腐蚀,开关K应该置于处。
若为锌,开关
置于
处,该电化学防护法称为。
(1)能源是当今社会发展的三大支柱之一。天然气是一种高效、低耗、污染小的清洁能源,主要成分为甲烷,甲烷燃烧的化学方程式为: ;
; 标准状况下,11.2L甲烷燃烧时,转移电子的物质的量为 mol。
标准状况下,11.2L甲烷燃烧时,转移电子的物质的量为 mol。

 s
s
 在如图构想的物质循环中太阳能最终转化为 能。
在如图构想的物质循环中太阳能最终转化为 能。
 (2)钢铁的腐蚀现象非常普遍,电化学腐蚀是造成钢铁腐蚀
(2)钢铁的腐蚀现象非常普遍,电化学腐蚀是造成钢铁腐蚀 的主要原因,某同学按右图进行钢铁腐蚀的模拟,则
的主要原因,某同学按右图进行钢铁腐蚀的模拟,则
负极的电
 极反应式为 ,
极反应式为 , 正极的电极反应式为 。
正极的电极反应式为 。 【提示:电化学的总反应式为2Fe+2H2O+O2=2Fe(OH)2】
【提示:电化学的总反应式为2Fe+2H2O+O2=2Fe(OH)2】 (3)海水化学资源的开发利用具有重要的意义和作用,下图是海带中提取碘的示意图:
(3)海水化学资源的开发利用具有重要的意义和作用,下图是海带中提取碘的示意图:

 操作①的名称是 ;反应②的离子方程式是 ,下述物质中不可做试剂③的是 。
操作①的名称是 ;反应②的离子方程式是 ,下述物质中不可做试剂③的是 。
| A.乙醇 | B.苯 | C.乙酸 | D.四氯化碳 |
钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程的有关问题。
(1)工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:
_________________________ 。
(2)生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式______________________。
(3)下列哪些装置可防止铁棒被腐蚀_____________ 。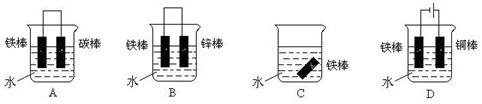
(4)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下: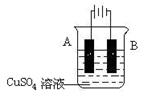
请回答:
① A电极对应的金属是 (写元素名称),B电极的电极反应式是 。
②镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因: 。
(12分)烧过菜的铁锅未及时洗净,第二天便出现红棕色锈斑(该锈斑为Fe(OH)3失 水的产物),试用有关的电极反应式,离子方程式和化学方程式表示Fe(OH)3的生成:
水的产物),试用有关的电极反应式,离子方程式和化学方程式表示Fe(OH)3的生成:
(1)负极______ ;
(2)正极_____  ;
;
(3)离子方程式______ ;
(4)化学方程式______ .
Ⅰ、铁及其化合物与生产、生活关系密切。
(1)右图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
①该电化腐蚀称为_____________,
②图中A、B、C、D、四个区域,生成铁锈最多的是__________(填字母).
(2)已知:Fe(s)+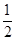 O2(g)═FeO(s)△H=-272kJ•mol-1
O2(g)═FeO(s)△H=-272kJ•mol-1
C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1
则高炉炼铁过程中FeO(s)+CO(g)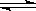 Fe(s)+CO2(g)△H=__________。
Fe(s)+CO2(g)△H=__________。
Ⅱ、甲醇是一种重要的化工原料和新型燃料。下图是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极.工作一段时间后,断开K,此时A、B两极上产生的气体体积相同.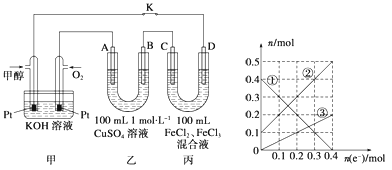
(1)甲中负极的电极反应式为__________。
(2)乙中A极析出的气体在标准状况下的体积为__________。
(3)丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图3,则图中②线表示的是__________的变化;反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要__________mL 5.0mol•L-1 NaOH溶液。
潜艇的金属外壳浸在海水中,在海水和空气的作用下会 被腐蚀
被腐蚀
(1)若海水呈中性,一艘钢制外壳的潜艇在海水中发生腐蚀的电极反应式为:
正极:___________________________________________________________ ______ _,负极:__________________________________________________________。
______ _,负极:__________________________________________________________。
(2)为有效地保护潜艇。下列措施中最好的是______________(填序号)
| A.采用纯铁制造潜艇外壳 | B.采用耐腐蚀的合金制造潜艇外壳 |
| C.在潜艇上涂一层油 | D.在潜艇外壳上装一定数量的锌块 |
金属的腐蚀是指金属与周围接触到的气体或液体物质发生________而引起损耗的现象。金属腐蚀的本质是________________,发生________反应。一般可分为________腐蚀和________腐蚀。
(6分)钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀。
在空气酸度不大的环境中,其负极是 ,负极反应式为 ;
正极是 ,正极反应式为 。