【化学——选修2:化学与技术】
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:

(1)在反射炉中,把铜精矿砂和石英砂混合加热到10000C左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物,该过程中两个主要反应的化学方程式分别是 , 反射炉内生成炉渣的主要成分是 ;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1200°C左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式分别是 ; ;

(3)粗铜的电解精炼如图所示。在粗铜的电解过程中,粗铜板应是图中电极 (填图中的字母);在电极d上发生的电极反应式为 ;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为 。
附加题:用铂作电极电解1 000 mL 0.1 mol/L AgNO3溶液,通电一段时间后关闭电源,测得溶液的质量减少了13.4 g。请回答:
(1)写现电解过程中阴极反应的电极反应式
(2)电解过程中流经外电路的电子数目为
(3)若电解前后溶液体积不变,则电解后溶液的pH为
(4)加入 使电解液彻底复原(填具体物质及其物质的量)。
按要求完成下列各题
(1)、精炼铜时,阴极材料是 ,阴极的电极反应式是 ,
(2)、氯碱工业电解饱和食盐水的总反应方程式为 。
(3)、MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是
(4)、为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-离子。电池工作时正极反应式为________________。
若以该电池为电源,用石墨做电极电解100 mL含有如下离子的溶液。
| 离子 |
Cu2+ |
H+ |
Cl- |
SO |
| c/(mol·L-1) |
1 |
4 |
4 |
1 |
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),阳极上收集到氧气的物质的量为________mol。
(6分)在某温度下,取一定质量的CuSO4溶液,用石墨做电极进行电解,当阳极产生标准状况下气体1.12 L时,CuSO4恰好被完全电解,得到密度为1.2 g/cm3的溶液200 mL。求:
(1)电解后,所得溶液的pH= 。
(2)电解前,所取CuSO4溶液的质量为 。
(3)若要使电解后所得溶液恢复至电解前的原始状态,需要加入 质量为 。
SO2、NO是大气污染物。吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):

(1)装置Ⅰ中生成HSO3-的离子方程式为 ;
(2)向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: ;
(3)装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3−、NO2−,写出生成NO3−的离子方程式_____ 。
(4)装置Ⅲ的作用之一是再生Ce4+,其原理如图所示。

①生成Ce4+的电极反应式为_____ 。
②生成Ce4+从电解槽的__________(填字母序号)口流出。
(5)已知进入装置Ⅳ的溶液中,NO2−的浓度为a g⋅L−1,要使1m3该溶液中的NO2−完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2___ L。(用含a代数式表示,计算结果保留整数)
按下图所示装置进行实验,并回答下列问题: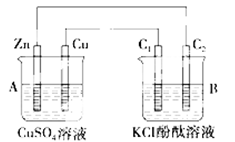
(1)锌极为________极,电极反应式为 ;
铜极为________极,电极反应式为 ;
(2)石墨棒C1为________极,电极反应式为 ;
石墨棒C2附近发生的实验现象为 。
(3)当C2极析出224 mL气体(标准状况)时,锌的质量 (填“增加”或“减少”) g ;
CuSO4溶液的质量 (填“增加”或“减少”) g。
如图所示是某乙醇燃料电池工作时的装置,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
(1)M电极的材料是______________,电极名称是______________;N极的电极反应式为___________,加入乙醇的铂电极的电极反应式为_________________。
(2)在此过程中,乙池中某一电极析出金属银4.32 g时,甲池中理论上消耗氧气____________L(标准状况下);若此时乙池溶液的体积为400 mL,则乙池中溶液的pH为____________。
(3)若在常温常压下,1 g C2H5OH燃烧生成CO2和液态H2O时放出29.71 kJ热量,表示该反应的热化学方程式为______________________。
如图甲、乙是电化学实验装置。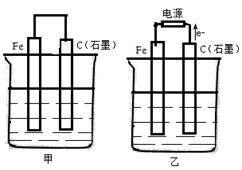
(1)若甲、乙两烧杯中均盛有NaCl溶液,则:
①甲中石墨棒上的电极反应式为 ;
②乙中总反应的离子方程式为 ;
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2 。若反应中Cl2和I2的物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为 。
(2)若甲乙两烧杯中均盛有足量CuSO4溶液,则:
①甲中铁棒上的电极反应式为 ;
②如果起始时乙中盛有200mLpH=5的CuSO4溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入的物质是 。(写化学式),其质量为 g。
2015年8月12日晚11时20分左右,天津港国际物流中心区域内瑞海公司所属危险品仓库发生的爆炸,造成了严重的人员伤亡,据瑞海国际官网信息,该公司仓储含以下种类物质:压缩气体天然气、易燃液体甲醇、乙酸乙酯、遇湿易燃物品电石、氰化钠、腐蚀品硫化碱等。
(1)由于CaC2、金属钠、金属钾以及固体NaH等物质能够跟水反应给灾后救援工作带来了很多困难。如果在实验室,你处理金属钠着火的方法是 。(填序号)其中固体NaH与水反应的方程式为
A.泡沫灭火器 B.消防车喷水 c.沙土
(2)硫化碱其实就是我们常见的硫化钠,触及皮肤和毛发时会造成灼伤。①其水溶液呈强碱性,故俗称硫化碱。 ②其水溶液在空气中会缓慢地氧化成Na2S2O3,该反应中还原剂与氧化剂物质的量之比为 。
(3)以上易燃液体甲醇是一种可再生能源,具有开发 和应用的广阔前景,如:

①2009年10月,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图1所示.
该电池正极的电极反应式为 ;负极的电极反应式 ;工作一段时间后,当6.4g甲醇完全反应生成CO2时,有 个电子发生转移.
②以上述电池做电源,用图2所示装置模拟氯碱工业,若只有铝棒和碳棒两个电极,则与电源负极相连的是 (铝棒或碳棒),写出电解该溶液总反应方程式
下图为相互串联的甲、乙两电解池试回答:

(1)若甲池利用电解原理在铁上镀银,则A是 (填电极材料),电极反应式是 ;B是 (填电极材料),电极反应式是 ,应选用的电解质溶液是 。
(2)乙池滴入少量酚酞试液,电解一段时间, (填“C”或“Fe”)极附近呈红色。
(3)若甲槽阴极增重43.2g,则乙槽中阳极上放出的气体在标况下的体积是_________L。
下列四个装置图均与电化学有关,请根据图示回答相关问题:
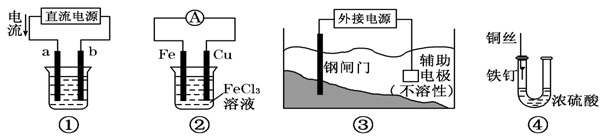
(1)这四个装置中,利用电解原理的是 (填装置序号);
(2)装置①若用来精炼铜,则a极的电极材料是 (填“粗铜”或“精铜”),电解质溶液为 ;
(3)装置②的总反应方程式是 ;
(4)装置③中钢闸门应与外接电源的 极相连(填“正”或“负”)
(5)装置④中的铁钉几乎没被腐蚀,其原因是 。
甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4(g) + H2O (g) =CO(g) + 3H2(g) △H =+206.0 kJ/mol
II:CO (g) + 2H2 (g) = CH3OH (g) △H =—129.0 kJ/mol
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为_______________。
(2)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100 L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图

假设100 ℃时达到平衡所需的时间为15min,则用H2表示该反应的平均反应速率为_______________。
(3)写出甲醇—空气—KOH溶液的燃料电池负极的电极反应式:______________。
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用下图装置模拟上述过程:

① 写出阳极电极反应式_______________。
② 写出除去甲醇的离子方程式_________________。
钠、镁、铁、铜及其化合物在科研和生产生活中有广泛的应用。
(1)Mg—H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,结构如图所示。电池工作时,正极的电极反应式 。常温下,用该电池电解200mL的饱和硫酸铜溶液(电极为惰性电极),反应时溶液中水的电离平衡 移动(填“向左”“向右”或“不”);当消耗24mg金属Mg,电解后溶液的pH= (不考虑溶液的体积变化)。

(2)利用电解法在铁制品上镀铜可以防止铁被腐蚀,以下说法正确的是 。
a.电镀时,铜和石墨都可以做阳极,可溶性铜盐作电解质溶液
b.电镀过程中,温度升高,电解反应速率加快
c.电镀过程中,电能全部转化为化学能
d.电镀过程中,铜离子向阴极移动,发生还原反应
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 |
Na+、K+、Cu2+ |
| 阴离子 |
SO42-、OH- |
在下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。
接通电源,经过一段时间后,测得乙烧杯中c电极质量增加了16 g。常温下各烧杯中溶液的pH与电解时间t的关系如图。据此回答下列问题:
(1)M为电源的_____极(填“正”或“负”),电极b上发生的电极反应为__________________________。
(2)电极e上生成的气体在标准状态下的体积为________。
(3)写出乙烧杯中的电解池反应_______________________。
(4)若电解过程中,乙烧杯中的B溶液中的金属离子全部析出,此时电解还能继续进行,原因是___________________________________。
(5)若经过一段时间后,测得乙烧杯中c电极质量增加了16 g,要使丙烧杯中的C溶液恢复到原来的状态,正确的操作是_____________________________________。