据报道,苹果公司开发了一种以液态甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月.下图是一个电化学过程的示意图.

已知甲池的总反应式为:2CH3OH+3O2+4KOH K2CO3+6H2O 请填空:
K2CO3+6H2O 请填空:
(1)充电时:①原电池的负极与电源______极相连,②阳极的电极反应为________.
(2)在此过程中若完全反应,乙池中B极的质量增加648g,则甲池中理论上消耗O2____L(标准状况下).
(3)电解制备Al(OH)3时,电极分别为Al片和石墨,电解总反应方程式为 。
电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:

(1)若X、Y都是惰性电极,a是AgNO3溶液,实验开始时,同时在两边各滴入几滴石蕊试液,则:
①电解池中Y电极上的电极反应式为 ;在Y电极附近观察到的实验现象是 ;检验该电极反应产物的方法是 。
②X电极上的电极反应式为 。
(2)如要用电解方法精炼粗镍,电解液a选用Ni(NO3)2溶液,则:①X电极的材料是 ,电极反应式为 。
②Y极的材料是 ,电极反应式为 。
(说明:杂质发生的电极反应不必写出)。
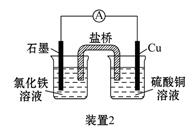
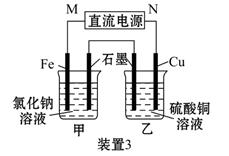
如图所示3套实验装置,分别回答下列问题: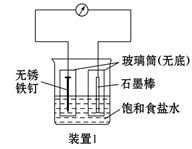
(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入铁钉的玻璃筒内滴入KSCN溶液呈无色,再滴入氯水即可观察到铁钉附近的溶液变红色,表明铁被_______;向插入碳棒的玻璃筒内滴入酚酞试液,可观察到碳棒附近的溶液变红,该电极反应为_______________。
(2)装置2中的石墨是_________极(填“正”或“负”),该装置发生的总反应的离子方程式为__________。
(3)装置3中甲烧杯盛放100 mL 0.2 mol·L-1的NaCl溶液,乙烧杯盛放100 mL 0.5 mol·L-1的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞试液,观察到石墨电极附近首先变红。
①电源的M端为_________极,甲烧杯中铁电极的电极反应为________________;
②乙烧杯中电解反应的离子方程式为______________;
③停止电解,取出Cu电极,洗涤、干燥、称量,电极增重0.64 g,则甲烧杯中产生的气体在标准状况下为________ mL。
在25 ℃时,用石墨电极电解2.0 L 0.5mol·L-1 CuSO4溶液。5min后,在一个石墨电极上有6.4 g Cu生成。试回答下列问题。
(1)发生氧化反应的是__________极,电极反应式为____________。
(2)若电解后溶液的体积不变,则电解后溶液的pH为____________。
(3)若将溶液恢复到与电解前一样,则需加入________mol的_______。
Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。
 (1)该电池的负极材料是_________。电池工作时,电子流向____________(填“正极”或“负极”)。
(1)该电池的负极材料是_________。电池工作时,电子流向____________(填“正极”或“负极”)。
 (2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是__________。欲除去Cu2+,最好选用下列试剂中的__________(填代号)。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是__________。欲除去Cu2+,最好选用下列试剂中的__________(填代号)。
 a.NaOH b.Zn c.Fe d.NH3·H2O
a.NaOH b.Zn c.Fe d.NH3·H2O
 (3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是 __________。若电解电路中通过2 mol电子,MnO2的理论产量为_______g。
__________。若电解电路中通过2 mol电子,MnO2的理论产量为_______g。
N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
(1)一定温度下,在恒容密闭容器中N2O5可发生下列反应:N2O5(g) 4NO2(g)+O2(g);ΔH>0
4NO2(g)+O2(g);ΔH>0
①反应达平衡后,再通入一定量N2O5,则N2O5的转化率将_______。(填““增大”“减小”或“不变”);
②下表为反应在T1温度下的部分实验数据:
| t/s |
0 |
500 |
1 000 |
| c(N2O5)/mol·L-1 |
5.00 |
3.52 |
2.48 |
则500s内N2O5的分解速率为_________________。
③在T2温度下,反应1000s时测得NO2的浓度为4.98 mol·L-1,则T2___________T1。
(2)下图所示装置可用于制备N2O5,则N2O5在电解池的_________区生成,其电极反应式为_________________。
如图所示装置,X、Y为电源的两极,a、b均为石墨电极,c为铜电极,d为铁电极,A槽中盛装饱和食盐水,B槽中盛装CuCl2溶液。通电一段时间后,发现d电极上覆盖一层红色物质。
根据以上实验事实,回答下列问题:
(1)c极的电极反应式为 ;
(2)A槽中发生反应的离子方程式为 ;
(3)A槽中溶液的pH (填“变大”、“变小”或“不变”)。
电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a:X、Y是两块电极板,通过导线与直流电源相连。请回答下列问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式为_______________,在X极附近观察到的现象是_____________。
②Y电极上的电极反应式为_______________,检测该电极反应产物的方法是_______________;
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是______,电极反应式是_______________;
②Y电极的材料是______,电极反应式是_______________;(说明:杂质发生的电极反应不必写出)
金属冶炼和处理常涉及氧化还原反应。
(1)由下列物质冶炼相应金属时采用电解法的是 。
| A.Fe2O3 | B.NaCl | C.Cu2S | D.Al2O3 |
(2)辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2=4CuSO4+2 H2O,该反应的还原剂是 ,当1mol O2发生反应时,还原剂所失电子的物质的量为 mol。
(3)下图为电解精炼银的示意图, (填a或b)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成的该气体为 ,电极反应为 。
大家知道:Cu+H2SO4(稀)= Cu SO4+H2通常不能反应。请回答:
(1)试说明此反应在一般情况下不能发生反应的原因是_________________。
(2)根据你所学过的知识,设法使其中的反应能发生,具体的方法是_________________;反应原理是:阳极__________________________
阴极__________________________
下列四个装置图均与电化学有关,请根据图示回答相关问题:
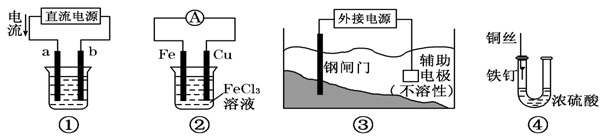
(1)这四个装置中,利用电解原理的是 (填装置序号);
(2)装置①若用来精炼铜,则a极的电极材料是 (填“粗铜”或“精铜”),电解质溶液为 ;
(3)装置②的总反应方程式是 ;
(4)装置③中钢闸门应与外接电源的 极相连(填“正”或“负”)
(5)装置④中的铁钉几乎没被腐蚀,其原因是 。
甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4(g) + H2O (g) =CO(g) + 3H2(g) △H =+206.0 kJ/mol
II:CO (g) + 2H2 (g) = CH3OH (g) △H =—129.0 kJ/mol
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为_______________。
(2)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100 L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图

假设100 ℃时达到平衡所需的时间为15min,则用H2表示该反应的平均反应速率为_______________。
(3)写出甲醇—空气—KOH溶液的燃料电池负极的电极反应式:______________。
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用下图装置模拟上述过程:

① 写出阳极电极反应式_______________。
② 写出除去甲醇的离子方程式_________________。
钠、镁、铁、铜及其化合物在科研和生产生活中有广泛的应用。
(1)Mg—H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,结构如图所示。电池工作时,正极的电极反应式 。常温下,用该电池电解200mL的饱和硫酸铜溶液(电极为惰性电极),反应时溶液中水的电离平衡 移动(填“向左”“向右”或“不”);当消耗24mg金属Mg,电解后溶液的pH= (不考虑溶液的体积变化)。

(2)利用电解法在铁制品上镀铜可以防止铁被腐蚀,以下说法正确的是 。
a.电镀时,铜和石墨都可以做阳极,可溶性铜盐作电解质溶液
b.电镀过程中,温度升高,电解反应速率加快
c.电镀过程中,电能全部转化为化学能
d.电镀过程中,铜离子向阴极移动,发生还原反应
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 |
Na+、K+、Cu2+ |
| 阴离子 |
SO42-、OH- |
在下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。
接通电源,经过一段时间后,测得乙烧杯中c电极质量增加了16 g。常温下各烧杯中溶液的pH与电解时间t的关系如图。据此回答下列问题:
(1)M为电源的_____极(填“正”或“负”),电极b上发生的电极反应为__________________________。
(2)电极e上生成的气体在标准状态下的体积为________。
(3)写出乙烧杯中的电解池反应_______________________。
(4)若电解过程中,乙烧杯中的B溶液中的金属离子全部析出,此时电解还能继续进行,原因是___________________________________。
(5)若经过一段时间后,测得乙烧杯中c电极质量增加了16 g,要使丙烧杯中的C溶液恢复到原来的状态,正确的操作是_____________________________________。