如图所示装置,均盛有等体积等浓度的稀硫酸,工作相同的时间后测得均通过n mol e-。下列叙述错误的是(不考虑溶液体积的变化)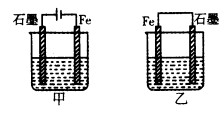
| A.铁棒的腐蚀程度:甲<乙 |
| B.碳电极上发生反应的电极反应式相同 |
| C.溶液的pH:甲减小,乙增大 |
| D.甲乙产生气体的体积(相同条件)比为3:2 |
某同学为研究电化学原理,使用KC1盐桥设计如图所示实验装置。下列分析不合理的是
| A.闭合K2断开K1,左侧烧杯中的Fe2+向铁电极移动 |
| B.无论闭合K1断开K2,还是断开K1闭合K2,石墨电极上发生的反应都是Fe3++e-= Fe2+ |
| C.闭合K1断开K2,电流从石墨电极经过K1流向铁电极 |
| D.闭合K1断开K2,左侧烧杯中的溶液pH将逐渐降低 |
关于下列装置的说法正确的是
| A.装置①中盐桥内的K+移向CuSO4溶液 |
| B.装置①将电能转变为化学能 |
| C.若装置②用于铁棒镀铜,则N极为铁棒 |
| D.若装置②用于电解精炼铜,溶液中的Cu2+浓度保持不变 |
电解法精炼含有Fe、Zn、Ag等杂质的粗铜。下列叙述正确的是
| A.电解时以硫酸铜溶液作电解液,精铜作阳极 |
| B.粗铜与电源负极相连,发生氧化反应 |
| C.阴极上发生的反应是Cu2++2e-=Cu |
| D.电解后Fe、Zn、Ag等杂质会沉积在电解槽底部形成阳极泥 |
铝和氢氧化钾都是重要的工业产品。工业品氢氧化钾的溶液中含有某些含氧酸杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示,下列说法正确的( )


| A.阳极产生KOH |
| B.阴极产生KOH |
| C.大量H+通过离子交换膜从左侧到右侧 |
| D.大量K+通过离子交换膜从右侧到左侧 |
用惰性电极电解下列溶液,其中随着电解的进行,溶液pH逐渐减小的是( )
①氯化钠溶液 ②硫酸铜溶液 ③氢氧化钠溶液 ④稀硫酸 ⑤稀盐酸 ⑥硫酸钠溶液
| A.①③⑤ | B.②④⑤ | C.②④ | D.②④⑥ |
关于镀铜和电解精炼铜,下列说法中正确的是( )
| A.都用粗铜作阳极、纯铜作阴极 |
| B.电解液的成分都保持不变 |
| C.阳极反应都只有Cu-2e-=Cu2+ |
| D.阴极反应都只有Cu2++2e-=Cu |
如图甲池和乙池中的四个电极都是惰性材料,请根据图示判断下列说法正确的是
| A.两个装置之间没有盐桥,故不能形成电流 |
| B.a电极的电极反应式 C2H5OH+16OH--12e-==2CO32-+11H2O |
| C.一段时间后,乙池d电极周围的溶液呈现棕褐色 |
| D.乙池在反应前后溶液的pH不变 |
下列说法正确的是( )
| A.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)能自发进行,则△H<0 |
| B.铁片镀锌时,铁片与外电源的正极相连 |
| C.以熔融NaCl为电解质进行电解冶炼钠,熔融体中Na+向阳极移动 |
D.t℃时,恒容密闭容器中反应:NO2(g)+SO2(g) NO(g)+SO3(g),通入少量O2, NO(g)+SO3(g),通入少量O2,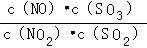 的值及SO2转化率不变 的值及SO2转化率不变 |
用惰性电极电解饱和NaCl溶液。下列有关的说法中,正确的是
| A.在阳极得到氯气,在阴极得到金属钠 |
| B.若在阳极附近滴入KI溶液,溶液呈棕色 |
| C.用阳离子交换膜电解,可防止C12进入阳极室 |
| D.,将电解后的溶液转移到烧杯中,搅拌后溶液呈中性 |
用图所示装置除去含CN—、Cl—废水中的CN—时,控制溶液pH为9~10,阳极产生的ClO—将CN—氧化为两种无污染的气体,下列说法不正确的是
| A.用石墨作阳极,铁作阴极 |
| B.阳极的反应式为:Cl-+2OH- -2e-=ClO-+H2O |
| C.阴极的反应式为:2H2O+2e-=H2↑+2OH- |
| D.除去CN-的反应:2CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O |
下列说法错误的是
| A.电解饱和食盐水可制取烧碱、氯气、氢气 |
| B.从海水中可提取镁、溴、碘等物质 |
| C.粗铜(含少量Zn、Fe、Pt等)电解精炼后,溶液中金属阳离子只有Fe2+、Zn2+ |
| D.在镀件上镀铜,镀件作阴极 |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
| A.放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2 |
B.充电时阳极反应为:Fe(OH)3-3e-+5OH-= +4H2O +4H2O |
| C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化 |
| D.放电时正极附近溶液的碱性增强 |
铅酸蓄电池是目前应用普遍的化学电池,新型液流式铅酸蓄电池以可溶性的甲基磺酸铅为电解质,电池总反应为:Pb+PbO2+4H+ 2Pb2++2H2O。下列有关新型液流式铅酸蓄电池的说法正确的是
2Pb2++2H2O。下列有关新型液流式铅酸蓄电池的说法正确的是
| A.放电时负极反应式为Pb-2e﹣+SO42﹣=PbSO4 |
| B.充放电时,溶液的导电能力变化不大 |
| C.以该电池电解NaCl溶液时,当消耗207gPb时,在阳极生成Cl222.4L |
| D.充电时的阳极反应式为Pb 2++2e-+4OH﹣=PbO2+2H2O |