美国斯坦福大学研究人员最近发明一种“水”电池,这种电池能利用淡水与海水之间含盐量的差别进行发电。海水中的“水”电池总反应可表示为:5MnO2 + 2Ag + 2NaCl=Na2Mn5O10 + 2AgCl
(1)写出负极电极反应式 。
(2)当生1 mol Na2Mn5O10时,转移电子的数目是 。
用上述电池电解尿素[CO(NH2)2]的碱性溶液制合成氨的装置如图(隔膜仅阻止气体通过,阴、阳极均为惰性电极)。

(3)写出A电极的名称 。
(4)写出电解时阳极的电极反应式 。
(5)已知电解排出液中n(OH-)/n(CO32-) =1,则起始时进入电解池中的原料配比n(KOH)/n[CO(NH2)2]是 。
化学反应与能量密不可分,回答下列问题。
(1)已知31g白磷变为31g红磷时释放能量。试回答:
①上述变化属于____化学(填“物理”或“化学”)变化。
②31g白磷的能量_____(“>”或“<”)31g红磷的能量。
(2)A、B、C三个烧杯中分别盛有200mL相同物质的量浓度的稀硫酸: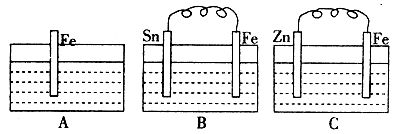
①分别写出B、C装置中铁片表面发生反应的电极反应式:
B______________________,C____________________。
②一段时间后,C中产生3.36L(标准状况下)气体时,硫酸恰好消耗完。此时,三个烧杯中液体质量由大到小的顺序为________(填字母),稀硫酸的物质的量浓度为________mol/L。
某学生利用下图实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64)。按照实验步骤依次回答下列问题: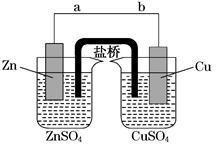
(1)导线中电子流向为____________(用a、b表示)。
(2)若装置中铜电极的质量增加0.64 g,则导线中转移的电子数目为________ (用“NA”表示);
(3)装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+、Cl-的移动方向的表述正确的是________。
| A.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动 |
| B.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动 |
| C.盐桥中的K+、Cl-都向左侧烧杯移动 |
| D.盐桥中的K+、Cl-几乎都不移动 |
(4)若将反应2Fe3++Cu===Cu2++2Fe2+设计成原电池,写出电极反应式。
正极反应______________;
(5)下列是用化学方程式表示的化学变化,请在每小题后的横线上注明能量的转化形式。
①电池总反应:Zn+Ag2O+H2O===Zn(OH)2+2Ag:__________。
②2C2H2+5O2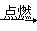 4CO2+2H2O:_________________。
4CO2+2H2O:_________________。
③6H2O+6CO2 C6H12O6(葡萄糖)+6O2:__________。
C6H12O6(葡萄糖)+6O2:__________。
有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol·L-1的H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。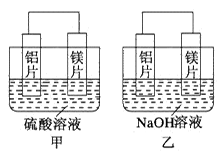
(1)甲中SO42-移向 极(填“铝片”或“镁片”)。写出甲中正极的电极反应式__________。
(2)乙中负极为________,总反应的离子方程式:_________________。此反应中氧化剂和还原剂的物质的量之比为 。
(3)上述实验也反过来证明了“直接利用金属活动性顺序表判断原电池中的正负极”这种做法_______(填“可靠”或“不可靠”)。如不可靠,请你提出另一个判断原电池正负极的可行性实验方案_____________(如可靠,此空可不填)。
利用如图装置,完成很多电化学实验。下列有关此装置的叙述中,正确的是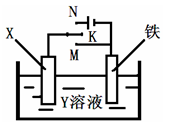
| A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓锌的腐蚀,这种方法称为牺牲阴极保护法。 |
| B.若X为碳棒,Y为NaCl溶液,开关K置于N处,可加快铁的腐蚀。 |
| C.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动。 |
| D.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,可用于铁表面镀铜,溶液中铜离子浓度将减小。 |
本题分为选做题(a)、(b)两道平行题,分值一样,可根据高一课程学习情况选择其中一道题完成作答,若二道题均作答,则按(a)题给分。
(a)有H、N、O、Na、Cl五种短周期主族元素。
(1)写出氯离子的原子结构示意图________,写出水分子的电子式________。
(2)NH4NO3是_______化合物(填“离子”或“共价”)。
(3)氯气是有毒气体,写出用饱和氢氧化钠溶液吸收氯气的离子方程式:_____________。
(4)金属元素铁是中学化学常见元素,将铁单质浸入氯化铁溶液中,该反应的离子方程式为__________。
(5)请依据(4)中的反应,设计一个原电池。要求:画出实验装置图,注明电解质溶液名称、正负极及正负极材料,并标出电子移动方向,写出电极反应式。
正极反应式:___________________,负极反应式:___________________。
(9分)将反应IO3-+5I-+6H+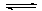 3I2+3H2O设计成如图所示的原电池。
3I2+3H2O设计成如图所示的原电池。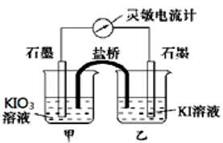
(1)开始时向甲烧杯中加入少量浓硫酸,电流计指针向右偏转,此时甲池中发生的电极反应式为____________,工作过程中关于电流计的读数,下列说法正确的是_______(填编号)
a.电流计读数逐渐减小 b.电流计读数有可能变为0
c.电流计读数一直不变 d.电流计的读数逐渐增大
(2)如果在加浓硫酸前,甲、乙烧杯中都加入淀粉溶液,则溶液变蓝的烧杯是_______(填“甲”、“乙”)。
(3)工作一段时间后,如果再向甲烧杯滴入浓NaOH溶液,此时乙池中发生的电极反应式为____________,电流计指针向_____(填“左”、“右”)偏转。
有A、B、C、D四种短周期元素,其原子序数依次增大。A、B可形成A2B和A2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物。回答下列问题。
(1)B在周期表中的位置______________。
(2)CB2通入A2B2溶液中可被氧化为W,方程式为____________。用W的溶液(体积为1L,假设变化前后溶液体积变化忽略不计)组装成原电池(如图所示)
电池总反应可表示为:PbO2 +Pb+ 2W= 2PbSO4 + 2H2O 。若电池中转移0.1 mol电子时,则W的浓度由质量分数39 % (密度1.3 g·cm-3)变为____________mol·L-1。
(3)金属元素E是中学化学常见元素,位于元素周期表的第四周期。该元素可与D形成ED2和ED3两种化合物。将E的单质浸入ED3溶液中(如下图甲所示),溶液由黄色逐渐变为浅绿色,该反应的离子方程式为_________________________。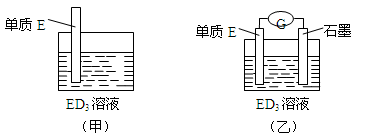
(4)依据(3)中的反应,可用单质E和石墨为电极设计一个原电池,则在该原电池工作时,石墨一极发生的反应可以表示为________________。比较甲、乙两图,说明石墨除形成闭合回路外所起的作用是 。
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验中不考虑两球的浮力变化)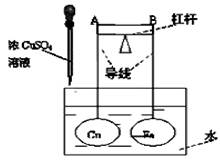
| A.杠杆为导体或绝缘体时,均为A端高B端低 |
| B.杠杆为导体或绝缘体时,均为A端低B端高 |
| C.当杠杆为导体时,A端低B端高;杠杆为绝缘体时,A端高B端低 |
| D.当杠杆为导体时,A端高B端低;杠杆为绝缘体时,A端低B端高 |
从能量的变化和反应的快慢等角度研究反应:2H2+O2=2H2O。
(1)为了加快正反应速率,可以采取的措施有________(填序号,下同)。
A.使用催化剂 B适当提高氧气的浓度
C.适当提高反应的温度 D.适当降低反应的温度
(2)下图能正确表示该反应中能量变化的是________。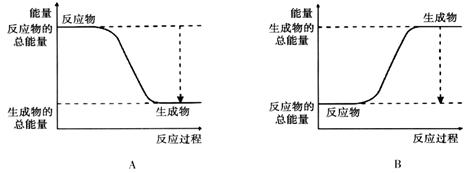
(3)从断键和成键的角度分析上述反应中能量的变化。
| 化学键 |
H—H |
O=O |
H—O |
| 键能kJ/mol |
436 |
496 |
463 |
请填写下表:
| 化学键 |
填“吸收热量”或“放出热量” |
能量变化kJ |
|
| 拆开化学键 |
2molH2和1molO2中的化学键 |
|
|
| 形成化学键 |
4molH—O键 |
|
|
| 总能量变化 |
|
|
(4)氢氧燃料电池的总反应方程式为2H2+O2=2H2O。其中,氢气在________极发生________反应。电路中每转移0.2mol电子,标准状况下消耗H2的体积是________L。
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用元素符号或化学用语回答下列问题:
| 族 周期 |
IA |
|
0 |
|||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
|
|
|
② |
|
③ |
|
|
| 3 |
④ |
|
⑤ |
⑥ |
|
|
⑦ |
|
(1)①和②形成的最简单有机化合物分子的结构式为_____________。
(2)下列事实能证明②的非金属性比⑥强的是
A.Na2CO3+SiO2 Na2SiO3+CO2↑
Na2SiO3+CO2↑
B.SiO2+2C Si+2CO↑
Si+2CO↑
C.Na2SiO3+CO2+2H2O=H2SiO3↓+Na2CO3
D.CH4比SiH4稳定
(3)写出①、③、④三种元素组成化合物的电子式___________。
(4)③、④、⑤所形成的简单离子半径由大到小的顺序:___ ____。
(5)①、②、⑦三种元素按原子个数之比为11︰5︰1组成的有机化合物中含有两个-CH3的同分异构体有 种。
(6)最近科学家制造了一种燃料电池,一个电极通入空气,另一电极通入液化石油气(以C4H10表示).电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.已知该电池的负极反应为:
C4H10+13O2--26e-===4CO2+5H2O
则该电池的正极反应为__________________,电池工作时,电池中O2-向________极移动.
某原电池装置如图所示,电池总反应为:2Ag+Cl2=2AgCl。下列说法正确的是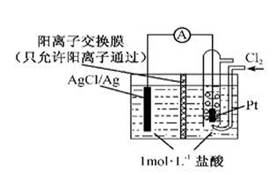
| A.正极反应为AgCl +e— =Ag +Cl- |
| B.放电时,交换膜右侧溶液中有大量白色沉淀生成 |
| C.若用NaCl溶液代替盐酸,则电池总反应随之改变 |
| D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少 0.02 mol离子 |
(10分)(1)在25℃、101 kPa下,1 g甲烷完全燃烧后,恢复到原状态放热Q kJ,则表示甲烷燃烧热的热化学方程式为_________________ 。
(2)肼(N2H4)一空气燃料电池是一种碱性环保电池,该电池放电时,负极的反应式为 。
(3)如图装置中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,乙烧杯中石墨电极附近pH值的变化为 (选填“变大”、“变小”、“不变”)。通电一段时间后(溶液中还有CuSO4),若要使乙烧杯中电解质溶液恢复到电解前的状态,可加入 (填序号).
| A.CuO | B.Cu(OH)2 | C.CuCO3 | D.Cu2(OH)2CO3 |
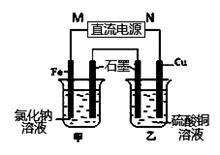
(4)下图是用于笔记本电脑的甲醇(CH3OH)燃料电池结构示意图,质子交换膜左右两侧的溶液均为500mL 2 mol/LH2SO4 溶液,当电池中有1mole-发生转移时,左右两侧溶液的质量之差为 (忽略气体的溶解,假设反应物完全耗尽)。
将下图所示实验装置的 K 闭合,下列判断正确的是
| A.片刻后甲池中c(SO42-)增大 | B.电子沿 Zn→a→b→Cu 路径流动 |
| C.Cu 电极上发生还原反应 | D.片刻后可观察到滤纸a点变红色 |
环境保护是现代的世界性课题,人类已在多方面取得了突破性进展。
(1)连续自动监测氮氧化物(NOx)的仪器——动态库仑仪已获得实际应用。它的工作原理如下图所示。NiO电极上NO发生的电极反应式为 。
(2)使用稀土催化剂有效消除汽车尾气中的NOx、碳氢化合物也已逐渐成为成熟技术。压缩天然气汽车利用这一技术将NOx、CH4转化成无毒物质,相关反应为:
①CH4(g)+4NO2(g)  4NO(g)+CO2(g)+2H2O(g) △H1<0
4NO(g)+CO2(g)+2H2O(g) △H1<0
②CH4(g)+4NO(g)  2N2(g)+CO2(g)+2H2O(g) △H2<0
2N2(g)+CO2(g)+2H2O(g) △H2<0
③CH4(g) +2NO2(g)  N2(g) +CO2(g) +2H2O(g) △H3
N2(g) +CO2(g) +2H2O(g) △H3
则△H3= (用△H1和△H2表示)。
(3)实验室在恒压下,将CH4(g)和NO2(g)置于密闭容器中发生反应③,测得在不同温度、不同投料比时,NO2的平衡转化率如下表:
| 投料比[n(NO2) / n(CH4)] |
400 K |
500 K |
600 K |
| 1 |
60% |
43% |
28% |
| 2 |
45% |
33% |
20% |
①在NO2与CH4反应时,可提高NO2转化率的措施有 (填编号)。
A.增加催化剂的表面积
B.改用高效催化剂
C.降低温度
D.增大压强
E.分离出H2O(g)
F.减小[n(NO2)/n(CH4)]
②400K时,将投料比为1的NO2和CH4的混合气体共0.40mol,充入容 积为2L的装有催化剂的密闭容器中,反应经过5min达到平衡,试计算反应在该温度时的平衡常数。(写出计算过程,计算结果保留三位有效数字)
③若温度不变,在反应进行到10min时将容器的容积快速压缩为1L,请在答题卷表格中画出0min~15min内,容器中CO2物质的量浓度c随时间变化的曲线图。
(4)SNCR是一种新型的烟气脱氮环保技术。在有氧条件下,其脱氮原理是:
NO(g)+4NH3(g)+O2(g) 4N2(g)+6H2O(g) △H= -1627.2kJ·mol-1
4N2(g)+6H2O(g) △H= -1627.2kJ·mol-1
NO和NH3在Ag2O催化剂表面的反应随温度的变化曲线如右图所示。图中曲线表明,随着反应温度的升高,在有氧的条件下NO的转化率有一明显的下降过程,其原因可能是(回答两条): 。