(本题16分)钒是一种重要的合金元素,还用于催化剂和新型电池。从含钒固体废弃物(含有SiO2、Al2O3及其他残渣)中提取钒的一种新工艺主要流程如图:
| 物质 |
V2O5 |
NH4VO3 |
VOSO4 |
(VO2)2SO4 |
| 溶解性 |
难溶 |
难溶 |
可溶 |
易溶 |
部分含钒化合物在水中的溶解性如上表:
请回答下列问题:
(1)反应①所得溶液中除H+之外的阳离子有___________。
(2)反应②碱浸后滤出的固体主要成分是(写化学式) 。
(3)反应④的离子方程式为 。
(4)25℃、101 kPa时,ⅰ、4Al(s)+3O2(g) 2Al2O3(s) ΔH1=-a kJ/mol
2Al2O3(s) ΔH1=-a kJ/mol
ⅱ、4V(s)+5O2(g) 2V2O5(s) ΔH2=-b kJ/mol
2V2O5(s) ΔH2=-b kJ/mol
用V2O5发生铝热反应冶炼金属钒的热化学方程式是 。
(5)钒液流电池(如图所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过。电池放电时负极的电极反应式为 ,电池充电时阳极的电极反应式是 。
(6)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应①后溶液中的含钒量,反应的离子方程式为:2V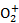 +H2C2O4+2H+
+H2C2O4+2H+ 2VO2++2CO2↑+2H2O。取25.00 mL 0.1000 mol/LH2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0 mL,由此可知,该(VO2)2SO4溶液中钒的含量为 g/L。
2VO2++2CO2↑+2H2O。取25.00 mL 0.1000 mol/LH2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0 mL,由此可知,该(VO2)2SO4溶液中钒的含量为 g/L。
(16分)硼镁泥是一种工业废料,主要成分是MgO,还有CaO、MnO、Fe2O3、FeO、Al2O3,、SiO2等杂质,以此为原料制取的硫酸镁可用于印染、造纸、医药等工业。从硼镁泥中制取MgSO4·7H2O的工艺流程如下:
已知:NaClO与Mn2+反应产生MnO2沉淀。
(1)实验中需用1.00 mol·L-1的硫酸80.0ml。若用98%的浓硫酸配制,除量筒、玻璃棒、胶头滴管外,还需要的玻璃仪器有_____________。
(2)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还有__________。
(3)“操作I”的主要操作为蒸发浓缩、冷却结晶、____________。
(4)写出加入NaClO时,溶液中氧化还原反应的离子方程式________________、_______________。
(5)已知:溶液的pH>3时,铝元素有多种存在形态,如A13+、[Al(OH)]2+、[Al(OH)2]+等,各形态之间可相互转化,写出该溶液中[Al(OH)]2+转化为[Al(OH)2]+的离子方程式_______________________。
(6)某同学为探究Ag+和Fe2+反应,按如图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移。电子由石墨经导线流向银。放置一段时间后,向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小—回到零点—逆向偏移。则电压表指针逆向偏移后,银为_______极(填“正”或“负”)。由实验得出Ag+和Fe2+反应的离子方程式是______________________。
(18分)I.碱性锌锰干电池的总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2。该电池中,负极材料是______,正极反应式为_______。
Ⅱ.以废旧锌锰干电池处理得到的混合物为原料制备锰锌铁氧体的主要流程如下图所示。
请回答下列问题:
(1)MnxZn1-xFe2O4中铁元素化合价为+3,则锰元素的化合价为__________。
(2)活性铁粉除汞时,铁粉的作用是_________(填“氧化剂”或“还原剂”)。
(3)除汞是以氮气为载气吹入滤液中,带出汞蒸气经KMnO4溶液进行吸收而实现的。在恒温下不同pH时,KMnO4溶液对Hg的单位时间去除率及主要产物如下图所示。
①写出pH=2时KMnO4溶液吸收汞蒸气的离子方程式_________。
②在强酸性环境中汞的单位时间去除率高,其原因除氢离子浓度增大使KMnO4;溶液的氧化性增强外,还可能是___________。
(4)用惰性电极电解K2MnO4溶液制备KMnO4的装置如图所示。
①a应接直流电源的____________(填“正”或“负”)极。
②已知25℃,两室溶液的体积均为100 mL,电解一段时间后,右室溶液的pH由10变为14,则理论上可制得_______mol KMnO4 (忽略溶液的体积和温度变化)。
现有A、B、C、D、E五种常见短周期元素,已知:
①元素的原子序数按A、B、C、D、E依次增大,原子半径按D、E、B、C、A顺序依次减小;
②A、D同主族,A是所有元素中原子半径最小的元素;B与C的位置相邻;C元素原子最外层电子数是次外层电子数的3倍;
③B、D、E三者的最高价氧化物有水化物依次为甲、乙、丙,它们两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素;
④B、E两种元素原子最外层电子数之和等于A、C、D三种元素原子最外层电子数之和。
请填写下列空白:
(1)写出乙+丙在溶液中反应的离子方程式 。
(2) 化合物BA3与BC在加热和有催化剂存在的条件下能发生反应,生成两种无毒物质,其反应的化学方程式为:___________________________________________。
(3)用电子式表示化合物D2C的形成过程 。
(4)某原电池中,电解质为KOH溶液,分别向负极通入碳元素与元素C(原子物质的量之比1:1)形成的化合物,向正极通入元素C最常见的单质,试完成下列问题:
正极反应:________________________;负极反应:________________________;
附加题:(共10分)铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等。回答下列问题:
(1)铅是碳的同族元素,比碳多4个电子层,则 PbO2的酸性比CO2的酸性 (填“强”或“弱”)。
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为 。
(3)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
①2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) △H=" a" kJ·mol-1
②PbS(s)+2PbO(s)=3Pb(s)+SO2(g) △H=" b" kJ·mol-1
③PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) △H=" c" kJ·mol-1
反应3PbS(s)+ 6O2(g)=3PbSO4(s) ΔH= kJ ·mol-1(用含a,b ,c的代数式表示)。
(4)引爆导弹、核武器的工作电源通常Ca/PbSO4热电池,其装置如图所示,该电池正极的电极反应式为 。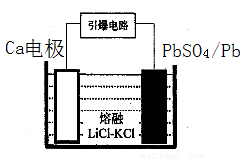
(5)PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重4.0%(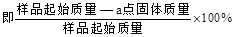 )的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,则计算x= _和m:n=_ _。
)的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,则计算x= _和m:n=_ _。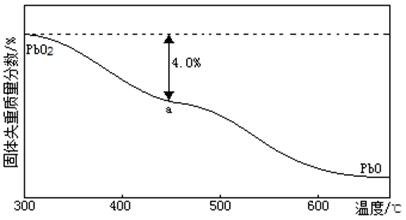
(8分)某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。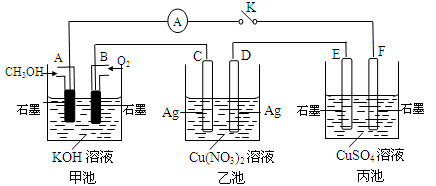
请回答下列问题:
(1)甲池为 (填“原电池”、“电解池”或 “电镀池”),A电极的电极反应式为 。
(2)丙池中F电极为 (填“正极”、“负极”、“阴极”或“阳极”),
该池的总反应方程式为 。
(3)当池中C极质量减轻10.8 g时,甲池中B电极理论上消耗O2的体积为 mL(标准状况)。
(4)一段时间后,断开电键K,加入下列物质能使丙池恢复到反应前浓度的是 (填选项字母)。
| A.Cu | B.CuO | C.Cu(OH)2 | D.Cu2(OH)2CO3 |
思考下列问题,按要求填空:
(1)某温度下纯水中c(H+) = 2×10-7 mol/L
①此时溶液中的C(OH-) = ___ __。
②若温度不变,向水中滴入稀盐酸使c (H+) = 5×10-6 mol/L,则此时溶液中的C(OH-) =___ __。
(2)已知下列热化学方程式:Zn(s)+ O2(g)="==ZnO(s)" △H1="-351.1" kJ·mol-1;
O2(g)="==ZnO(s)" △H1="-351.1" kJ·mol-1;
Hg(l)+ O2(g)="==HgO(s)" △H2="-90.7" kJ·mol-1
O2(g)="==HgO(s)" △H2="-90.7" kJ·mol-1
由此可知反应Zn(s)+HgO(s)===ZnO(s)+Hg(l)的焓变为___ __。
(3)在稀氨水中存在下述电离平衡NH3+H2O  NH3 ·H2O
NH3 ·H2O  NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?___ __(填“增大”、“减小”或“不变”);平衡移动方向如何?___ __(填“正向”、“逆向”或“不移动”)。
NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?___ __(填“增大”、“减小”或“不变”);平衡移动方向如何?___ __(填“正向”、“逆向”或“不移动”)。
| 加入的物质 |
少量(NH4)2SO4固体 |
少量HNO3溶液 |
少量KOH溶液 |
| c(OH-)的变化 |
|
减小 |
|
| 平衡移动方向 |
逆向 |
|
逆向 |
(4)如图所示,装置B中两电极均为石墨电极,试回答下列问题:
①判断装置的名称:A池为____ ____。
②锌极为___ ___极,电极反应式为_____ _______;
③当C2极析出224 mL气体(标准状况下),锌的质量减少_ _g
(1)据报道以硼氢化合物NaBH4(H的化合价为-1价) 和 H2O2作原料的燃料电池,可用作通信卫星电源。负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示。写出该电池放电时负极的电极反应式: 。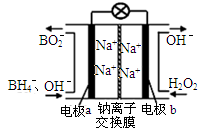
(2)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂。
已知:N2H4(l) + O2(g) = N2(g)+ 2H2O(l) △H =" –" 534 kJ·mol—1
H2O2(l)= H2O(l) + 1/2O2(g) △H =" –" 98.6 kJ·mol—1
写出常温下,N2H4(l) 与H2O2(l)反应生成N2和H2O的热化学方程式: 。
(3)O3可由臭氧发生器(原理如图所示)电解稀硫酸制得。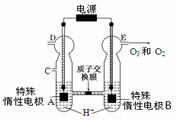
①图中阴极为 (填“A”或“B”)。
②若C处通入O 2,则A极的电极反应式为: 。
(4)向一密闭容器中充入一定量的一氧化碳和水蒸气,发生反应:
CO(g)+H2O(g) CO2(g)+H2(g),下列情况下能判断该反应一定达到平衡状态的是_______(选填编号)。
CO2(g)+H2(g),下列情况下能判断该反应一定达到平衡状态的是_______(选填编号)。
| A.v正(H2O) = v逆(H2) |
| B.容器中气体的压强不再发生改变 |
| C.H2O的体积分数不再改变 |
| D.容器中CO2和H2的物质的量之比不再发生改变 |
E.容器中气体的密度不再发生改变
(5)温度T1时,在一体积为2L的密闭容积中,加入0.4molCO2和0.4mol的H2,反应中c(H2O)的变化情况如图所示,T1时反应CO(g)+H2O(g) CO2(g)+H2(g)第4分钟达到平衡。在第5分钟时向体系中同时再充入0.1molCO和0.1molH2(其他条件不变),请在右图中画出第5分钟到9分钟c(H2O)浓度变化的曲线。
CO2(g)+H2(g)第4分钟达到平衡。在第5分钟时向体系中同时再充入0.1molCO和0.1molH2(其他条件不变),请在右图中画出第5分钟到9分钟c(H2O)浓度变化的曲线。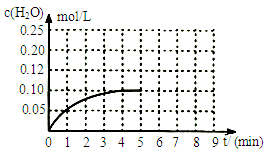
氯化硫酰(SO2Cl2)是一种无色液体,遇水剧烈水解,其熔点为-54.1 ℃,沸点为69.1 ℃,可用作氯化剂及锂电池正极活性物质。氯化硫酰可用下列反应制取:
SO2(g)+Cl2(g) SO2Cl2(l) △H=-97.3 kJ/mol。
SO2Cl2(l) △H=-97.3 kJ/mol。
(1)为了提高上述反应中Cl2的平衡转化率,下列措施合理的是(用字母编号填写): 。
a.缩小容器体积 b.使用催化剂 c.提高SO2浓度 d.提高温度
(2)300 ℃时,在体积为1 L的密闭容器中充入16.20 g SO2Cl2,达到平衡时容器中含SO2 7.616 g,则300 ℃时合成SO2Cl2反应的平衡常数的为: 。
(3)某同学设计了下图所示装置制取氯化硫酰:
①有关该装置的说法正确的是(用字母编号填写): 。
a.A、E处洗气瓶中盛放的可能分别是饱和食盐水和饱和NaHSO3溶液
b.B处反应管内五球中玻璃棉上的活性炭起催化作用
c.B处反应管的冷却水应从m接口通入
d.装置C处吸滤瓶应放在冰水中冷却
e.D处U形管中盛放的可能是碱石灰
②从化学平衡的角度分析,反应管通冷却水的目的是: 。
③氯磺酸(ClSO3H)受热分解也可制得氯化硫酰,并得到另外一种物质,该反应的化学方程式为______,分离产物的方法是: 。
(4)下图为GET公司开发的Li-SO2Cl2军用电池的示意图。已知该电池的总反应为:2Li+SO2Cl2=2LiCl+SO2↑,则该电池工作时的正极反应为:_______________________。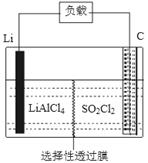
黄铁矿(主要成分FeS2)、黄铜矿(主要成分CuFeS2)均是自然界中的常见矿物资源。
(1)Stumm和Morgan提出黄铁矿在空气中氧化的四步反应如题20图-1所示:
① a反应中每生成1molFeSO4转移电子的物质的量为 mol。
② d反应的离子方程式为 。
(2)用细菌冶铜时,当黄铜矿中伴有黄铁矿可明显提高浸取速率,其原理如题20图-2
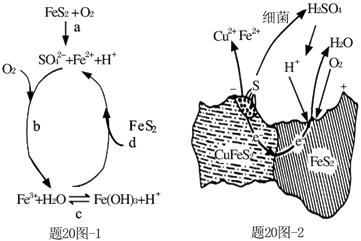
①冶炼过程中,正极周围溶液的pH (选填:“增大”、“减小”或“不变”)
②负极产生单质硫的电极反应式为 。
|
(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见下表),其相关反应的平衡常数的对数值与温度的关系如题20图-3。
| 相关反应 |
反应热 |
平衡常数K |
FeS2(s) + H2(g)  FeS(s) + H2S(g) FeS(s) + H2S(g) |
ΔH1 |
K1 |
1/2 FeS2(s) + H2(g) 1/2Fe(s)+H2S(g) 1/2Fe(s)+H2S(g) |
ΔH2 |
K2 |
FeS(s) + H2(g) Fe(s)+H2S(g) Fe(s)+H2S(g) |
ΔH3 |
K3 |
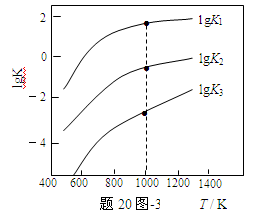
①上述反应中,ΔH1 0(选填:“>”或“<”)。
②提高硫的脱除率可采取的措施有 (举1例)。
③1000K时,平衡常数的对数lgK1、lgK2和lgK3之间的关系为 。
A~F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示。
| 元素 |
原子结构或性质 |
| A |
原子最外层电子数是内层电子总数的1/5 |
| B |
形成化合物种类最多的元素,其单质为固体 |
| C |
生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
| D |
地壳中含量最多的元素 |
| E |
与D同主族 |
| F |
与E同周期,且最外层电子数等于电子层数 |
请回答下列问题:(用对应的化学用语回答)
(1)B在元素周期表中的位置是__________;用电子式表示A和E形成的化合物的形成过程 。
(2)A、 D 、E、 F离子半径由大到小的顺序为________________________________。
(3)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是__________________;
(4)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是____________________。该反应为 反应。(填“吸热”或“放热”)
(5)F的最高价氧化物与E的最高价氧化物的水化物反应的离子方程式为 。
(6)如图:将A和F的单质与烧碱液构成原电池,负极的电极反应式为 ;外电路中电子从 电极流向 电极 。
观察下列几个装置示意图,有关叙述正确的是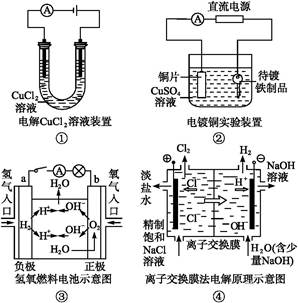
| A.装置①中阳极上析出红色固体 |
| B.装置②的待镀铁制品应与电源正极相连 |
| C.装置③闭合电键后,外电路电子由a极流向b极 |
| D.装置④的离子交换膜允许阳离子、阴离子、水分子自由通过 |
(15分)卤素的单质及其化合物在生产、生活中应用广泛。
(1)“碘盐"通常是在食盐中添加适量的K1O3,为缺碘地区人们提供碘元素。
①碘元素的一种原子含74个中子、5 3个质子,表示此核素的符号是___(如 )。
)。
②“碘盐"溶液用稀硫酸酸化后,再加入淀粉碘化钾溶液,溶液由无色变篮色。
写出该反应的化学方程式__________________________________________。
③碘单质溶解在有机溶剂___________中形成常用的医用消毒剂(填结构简式)。
(2)工业上利用氢气和氯气反应制取盐酸,设计成原电池又能获取电能,下列说法错误的是___(填选项)。
| A.两极材料可用石墨,用稀盐酸做电解质溶液 |
B.通氯气的电极反应式为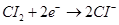 |
| C.电解质溶液中的阳离子向通氯气的电极移动‘ |
| D.通入氢气的电极为原电池的正极 |
(3)H2和卤素单质(F2、C12、Br2、12)反应生成I molHX的能量变化如图所示(反应物和产物均为298K时的稳定状态)。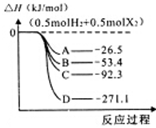
①曲线A代表的卤化氢是__________(填化学式)。
②写出Br2(1)与HCI气体反应的热化学方程式___________。
③往甲乙两容器分别通入等量的H2和I2,两容器起始状态相同,甲为恒容绝热密闭容器,乙为恒容恒温密闭容器,发生反应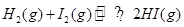 ,反应达到平衡后,H2的体积分数甲_______乙(填“>’’‘‘=”或“<”)。
,反应达到平衡后,H2的体积分数甲_______乙(填“>’’‘‘=”或“<”)。
(14 分)碳及其化合物应用广泛。
I.工业上利用CO和水在沸石分子筛表面反应制氢气,CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
(1)向 1L恒容密闭容器中注入CO和H2O(g),830oC时,测得部分数据如下表。
| t/min |
0 |
1 |
2 |
3 |
4 |
5 |
| n(CO)/mol |
0.200 |
0.160 |
0.125 |
0.099 |
0.080 |
0.080 |
| n(H2O)/mol |
0.300 |
0.260 |
0.225 |
0.199 |
0.180 |
0.180 |
则该温度下反应的平衡常数K=
(2)相同条件下,向 1L恒容密闭容器中,同时注入1molCO、1molH2O(g)、2molCO2和2molH2,此时
v(正) v(逆)(填“>”“=”或“<”)
II.已知:CO(g)+1/2O2(g)=CO2(g) △H1=-141kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H2=-484kJ·mol-1
CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(g) △H3=-726kJ·mol-1
(3)利用CO、H2化合制得液态甲醇的热化学方程式为
Ⅲ.一种新型氢氧燃料电池工作原理如下图所示。
(4)写出电极A的电极反应式 ,放电过程中,溶液中的CO32-将移向电极 (填A或B)
(5)以上述电池电解饱和食盐水,若生成0.2mol Cl2,则至少需通入O2的体积为 L(标准状况)
电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请完成以下问题: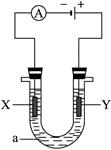
(1)若X、Y者是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中化学反应方程式为_____________,在X极附近观察到的现象是_________________。
②检验Y电极上反应产物的方法是_________________________。
③当导线中有0.1 mol的电子通过时,在标况下理论上两极可收集的气体的体积是__ __L。
(2)下图装置中,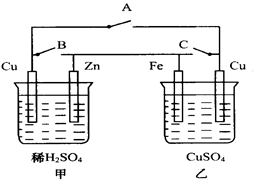
①当A键断开,B、C闭合时,乙为 池;
②当A、C两键断开, B闭合时,乙中铁极增重1.6g,则被氧化的铁有 g;
③将乙中两极都换成石墨,硫酸铜溶液换H2SO4后断开B、C两键, 闭合A键,则乙为 池,当甲中锌极减轻6.5g时,乙中共放出气体 mL(标况)。