我们可以通过以下实验步骤来验证醋酸银(CH3COOAg)的溶度积KSP=2.0×10-3:将已知质量的铜片加入到CH3COOAg饱和溶液中(此饱和溶液中没有CH3COOAg固体),待充分反应之后,将铜片冲洗 干净、干燥、称重.
干净、干燥、称重.
(1)写出表示CH3COOAg沉淀溶解平衡的方程式.
(2)刚开始铜片的质量为23.4 g,将铜片放在100 mL的CH3COOAg饱和溶液中,通过 计算说明当充分反应
计算说明当充分反应 后铜片的质量为何值时,CH3COOAg的KSP=2.0×10-3可以得到证实.(
后铜片的质量为何值时,CH3COOAg的KSP=2.0×10-3可以得到证实.(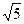 =2.24,
=2.24,  =1.41)
=1.41)
已知25℃时,AgI饱和溶液中c(Ag+)为1.22×10-8mol·L-1,AgCl的饱和溶液中c(Ag+)为1.30×10-5mol·L-1。若在5 mL含有KCl和KI浓度均为0.01 mol·L-1的混合溶液中,滴加8 mL 0.01 mol·L-1的AgNO3溶液,则下列叙述中不正确的是
| A.反应后溶液中离子浓度大小关系为:c(NO3-)>c(Ag+)>c(Cl-)>c(I-) |
| B.溶液中先产生的是AgI沉淀 |
| C.AgCl的KsP的数值为1.69×10-10 |
| D.若在AgCl悬浊液中滴加KI溶液,白色沉淀会转变成黄色沉淀 |
下列说法正确的是
| A.pH=7的溶液一定是中性溶液 |
| B.能自发进行的化学反应,不一定是△H<0、△S>0 |
| C.白色污染、绿色食品中的“白”“绿”均指相关物质的颜色 |
| D.Ksp不仅与难溶电解质的性质和温度有关,而且与溶液中的离子浓度有关 |
下表是五种银盐的溶度积常数(25℃):
| 化学式 |
AgCl |
Ag2SO4 |
Ag2S |
AgBr |
AgI |
| 溶度积 |
1.8×10-10 |
1.4×10- |
6.3×10-50 |
5.4×10-13 |
8.3×10-17 |
下列说法不正确的是:
| A.五种物质在常温下溶解度最大的是Ag2SO4 |
| B.将氯化银溶解于水后,向其中加入Na2S,则可以生成黑色沉淀Ag2S |
| C.氯化银、溴化银和碘化银三种物质在常温下的溶解度随着氯、溴、碘的顺序增大 |
| D.沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动 |
中学化学教材中有大量数据,下列为某同学对数据的利用情况,其中不正确的是:
| A.用溶解度数据判断煮沸Mg(HCO3)2溶液得到的产物是Mg(OH)2而不是MgCO3。 |
| B.用pH数据推测不同强酸弱碱盐在水溶液中水解程度的大小。 |
| C.用反应热数据的大小判断不同反应的反应速率的快慢。 |
| D.用平衡常数的大小判断化学反应可能进行的程度。 |
中学化学教材中有大量数据,下列为某同学对数据的利用情况,其中不正确的是:
| A.用溶解度数据判断煮沸Mg(HCO3)2溶液得到的产物是Mg(OH)2而不是MgCO3 。 |
| B.用pH数据推测不同强酸弱碱盐在水溶液中水解程度的大小。 |
| C.用反应热数据的大小判断不同反应的反应速率的快慢。 |
| D.用平衡常数的大小判断化学反应可能进行的程度。 |
已知:25°C时,Ksp〔Mg(OH)2〕=5.61×10-12,Ksp〔MgF2〕=7.42×10-11。下列说法正确的是
| A.25°C时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 |
| B.25°C时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大 |
| C.25°C时,Mg(OH)2固体在20mL0.01 mol·L-1氨水中的Ksp比在20mL0.01mol·L-1NH4Cl溶液中的Ksp小 |
| D.25°C时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2 |
已知氯化银在水中存在沉淀溶解平衡:AgCl Ag+ + Cl-,25℃时氯化银的KSP=1.8×10-10。现将足量的氯化银分别放入下列选项的溶液中,充分搅拌后,相同温度下,银离子浓度最小的是
Ag+ + Cl-,25℃时氯化银的KSP=1.8×10-10。现将足量的氯化银分别放入下列选项的溶液中,充分搅拌后,相同温度下,银离子浓度最小的是
| A.100mL蒸馏水中 | B.50mL0.1mol?L-1的氯化镁溶液 |
| C.100mL0.1mol?L-1的氯化钠溶液 | D.50mL0.1mol?L-1的氯化铝溶液 |
(1)某温度(t℃)时,测得0.01 mol·L-1 的NaOH溶液的pH=13,请回答下列问题:
①该温度下水的Kw= 。
②此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合(忽略体积变化),若所得混合液为中性,且a=12,b=2,则Va︰Vb= 。
(2)已知25°C时Ksp(Mg(OH)2)=1.8×10-11,为除去某食盐溶液中的Mg2+,可用NaOH为除杂试剂,当控制溶液PH=12时,可确保Mg2+除尽,此时溶液中Mg2+的物质的量浓度为 .
在石灰乳中存在平衡体系:Ca(OH)2(s) Ca2+(aq)+2OH-(aq),下列方法中,能使c(Ca2+)减小、c(OH-)增大的是
Ca2+(aq)+2OH-(aq),下列方法中,能使c(Ca2+)减小、c(OH-)增大的是
| A.加入少量MgCl2固体 | B.加入少量Na2CO3固体 |
| C.加入少量KCl固体 | D.加入少量CaO固体 |
25℃时,KSP[Mg(OH)2]=5.6×10-12, KSP[MgF2]=7.42×10-11,在该温度下进行下列实验,回答相关问题:
(1)在同浓度的含OH-和F-的溶液中,逐滴加MgCl2溶液时,最先产生的沉淀是____①____
(2)Mg(OH)2可溶液于浓NH4Cl溶液,试解释产生该现象的原因___②___(用离子方程式表示)
(3)有人认为“难溶盐不能和碱溶液发生复分解反应”。若在MgF2悬浊液中滴加NaOH溶液,能否发生化学反应?若你认为能反应的,请写出该反应的离子方程式;若你认为不能反应的请说明理由。____③____
某温度时,水的离子积常数KW=10-13,将此温度下pH=11的Ba(OH)2溶液a L与pH=1的H2SO4溶液bL混合。设混合溶液体积为两者之和,所得固体体积忽略不计。
(1)若所得混合溶液为中性,则a︰b= ,生成沉淀的物质的量为 mol。
(最终结果用含a的式子表达)
(2)若a︰b=9︰2,则所得溶液pH= 。若混合后溶液的总体积为220mL,则该混合溶液最多能溶解铁粉 g。
根据下图溶解度曲线,在恒定70℃将物质的量浓度相等的硝酸钠溶液和氯化钾溶液等体积混合降温至25℃,首先析出的是
| A.氯化钠 |
| B.硝酸钠 |
| C.氯化钾 |
| D.硝酸钾 |
CrO3和K2Cr2O7均易溶于水,这是工业上造成铬污染的主要原因。净化处理方法之一是将含+6价Cr的废水放入电解槽内,用铁作阳极,加入适量的NaCl进行电解:阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去(已知Ksp Fe(OH)3=4.0×10-38,Ksp Cr(OH)3=6.0×10-31)。已知电解后的溶液中c(Fe3+)为4×10-14 mol·L-1,此时溶液的pH(室温下测得)和溶液中c(Cr3+)分别为
| A. 6; 6×10-7 mol·L-1 | B. 7; 1×10-5 mol·L-1 |
| C.7 ; 4×10-8 mol·L-1 | D. 6; 1× 10-5 mol·L-1 |
海水中含有丰富的镁资源。某同学设计了从模拟海水中制备的实验方案:

| 模拟海水中的离子 |
|
|
|
|
|
| 浓度( |
0.439 |
0.050 |
0.011 |
0.560 |
0.001 |
注:溶液中某种离子的浓度小于,可认为该离子不存在;
实验过程中,假设溶液体积不变
下列说法正确的是
| A. |
沉淀物
|
| B. |
溶液
|
| C. |
溶液
|
| D. |
步骤②中若改为加入4.2
|