AgCl固体溶解在水中形成饱和溶液(AgCl固体有剩余),下列说法正确的是 ( )
| A.AgCl沉淀生成和沉淀溶解不断进行,但速率相等 |
| B.在此饱和溶液中加水,KSP(AgCl)增大 |
| C.在此饱和溶液中加浓的Na2S溶液,生成黑色沉淀 |
| D.向AgCl饱和溶液中加入NaCl固体,c(Ag+)不变 |
高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
(1)请完成FeO42-与水反应的方程式:4FeO42-+10H2O 4Fe(OH)3+8OH-+_____。
4Fe(OH)3+8OH-+_____。
K2FeO4在处理水的过程中所起的作用是 和 。
(2)常温下,Fe(OH)3 的Ksp = 4.0×10-38,请写出Fe(OH)3在水中的溶解平衡方程式
(3)将适量K2FeO4配制成c(FeO42-) =1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ。第(1)题中的反应为FeO42-变化的主反应,则温度对该反应的反应速率和平衡移动的影响是 ;发生反应的△H 0(填“>”、“<”或“=”)。
(4)FeO42-在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是 (填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=2的这种溶液中加KOH溶液至pH=10,HFeO4-的分布分数先增大后减小
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:
H2FeO4+OH-=HFeO4-+H2O
某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示,下列说法中不正确的是
| A.b点对应的Ksp等于c点对应的Ksp |
| B.采取蒸发溶剂的方法可以使溶液从a点变到b点 |
| C.该温度下,Ag2SO4的溶度积常数(Ksp)为1.6×10-5(mol·L-1)2 |
| D.0.02mol·L-1的AgNO3溶液与的0. 2mol·L-1的Na2SO4溶液等体积混合不会生成沉淀 |
对于一个化学反应的研究需要从反应条件、限度、速率、定量关系等因素进行综合分析,下列是关于化学反应的系列研究,请根据相关信息回答问题。
⑴关于反应物之间的定量关系的研究:
已知反 应:Br2 +2Fe2+=2 Br -+2Fe3+,向10 mL0 .1mol/L的Fe Br2溶液中通入0 .003mol Cl2,该反应的离子方程式为
应:Br2 +2Fe2+=2 Br -+2Fe3+,向10 mL0 .1mol/L的Fe Br2溶液中通入0 .003mol Cl2,该反应的离子方程式为
⑵关于反应速率、限度的研究:
①已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,在氯化镁溶液中加入一定量的烧碱,测得pH=13.0,则此温度下残留在溶液中的c(Mg 2+)=
②科学研究发 现纳米级的Cu2O可作为太阳光分解水的催化剂。
现纳米级的Cu2O可作为太阳光分解水的催化剂。
一定温度下 ,在2L密闭容器中加入纳米级的Cu2O并通入0 .1mol水蒸气,发生反应:
,在2L密闭容器中加入纳米级的Cu2O并通入0 .1mol水蒸气,发生反应: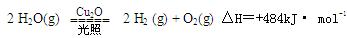 2 H2O(g)
2 H2O(g)
2 H2(g) + O2(g)△H=+484kJ· mol-1,不同时段产生O2的量见下表:
| 时间/min |
20 |
40 |
60 |
80 |
| n(O2)/mol |
0.0010 |
0.0016 |
0.0020 |
0.0020 |
则前20min的反应速率v(H2O)= ;达到平衡时,至少需要吸收的光能为 kJ。
③向某密闭容器中加入0 .3molA、0 .1molC和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如下图中甲图所示。附图中乙图为t2时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且四个阶段都只改变一种条件。已知t3~t4为使用催化剂,甲图中t0~t1阶段c (B)未画出。请回答:
Ⅰ:t4~t5阶段改变的条件是 t5~t6阶段改变的条件是
Ⅱ:B的起始浓度为 ,该反应方程式为
某温度下,将Fe(OH)3(s)、Cu(OH)2(s) 分别置于蒸馏水中达到沉淀溶解平衡后,金属阳 离子浓度随溶液 的变化如图所示。下列判断正确的是
的变化如图所示。下列判断正确的是
A.加适量浓NH3·H2O可使溶液由 点变到 点变到 点 点 |
B.  两点代表的溶液中 两点代表的溶液中 与 与 乘积不相等 乘积不相等 |
C.Cu(OH)2在 点比在d点代表的溶液中溶解程度小 点比在d点代表的溶液中溶解程度小 |
D.该温度下,氢氧化铁的 |
(10分)如表是不同温度下水的离子积数据:试回答以下问题:
| 温度/℃ |
25 |
t1 |
t2 |
| 水的离子积常数 |
1×10-14 |
KW |
1×10-12 |
(1)若25<t1<t2,则KW___1×10-14(填“>”、“<”或“=”),作出此判断的理由是__。
(2)25℃下,某Na2SO4溶液中c(SO)=5×10-4mol·L-1,取该溶液1 mL,加水稀释至10 mL,则稀释后溶液中c(Na+):c(OH-)=__________。
(3)t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH =2,则V1:V2=_______。此溶液中各种离子的浓度由大到小的排列顺序是___________。
一定温度下,氢氧化镁的悬浊液中存在下列平衡:Mg(OH)2(s) Mg2+(aq)+2OH—(aq),保持温度不变,向其中加入下列物质,可使悬浊液中氢氧化镁固体质量减少的是
Mg2+(aq)+2OH—(aq),保持温度不变,向其中加入下列物质,可使悬浊液中氢氧化镁固体质量减少的是
| A.H2O | B.MgCl2固体 | C.NaOH 固体 | D.NH4C1固体 |
一定温度下,难溶电解质在饱和溶液中各离子浓度幂的乘积是一个常数,这个常数称为该难溶电解质的溶度积,用符号Ksp表示。
即:AmBn(s)  mAn+(aq)+nBm-(aq) [An+]m·[Bm-]n=Ksp
mAn+(aq)+nBm-(aq) [An+]m·[Bm-]n=Ksp
已知:某温度时,Ksp(AgCl)=[Ag+][Cl-] =1.8×10-10
Ksp(Ag2CrO4)=[Ag+]2[CrO2- 4] =1.1×10-12
1.81/2="1.3 " 2751/3=6.5
试求:
(1)此温度下AgCl饱和溶液和Ag2CrO4饱和溶液的物质的量浓度,并比较两者的大小。
(2)此温度下,在0.010mo1·L-1的AgNO3溶液中,AgCl与Ag2CrO4分别能达到的最大物质的量浓度,并比较两者的大小。
(6分)氢氧化铜悬浊液中存在如下平衡:
Cu(OH)2(s) Cu2+(aq)+2OH-(aq),常温下其Ksp=2×10-20则:
Cu2+(aq)+2OH-(aq),常温下其Ksp=2×10-20则:
(1)某硫酸铜溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH大于 。
(2)除去CuCl2溶液中少量的Fe2+,可以按照下面的流程进行:
已知Fe2+、Cu2+、Fe3+ 三种离子开始沉淀和完全沉淀时溶液pH值如下:
| 金属 离子 |
pH |
|
| 开始沉淀 |
完全沉淀 |
|
| Fe2+ |
7.6 |
9.6 |
| Cu2+ |
4.4 |
6.4 |
| Fe3+ |
2.7 |
3.7 |
①下列物质中适合作为试剂X的是 A.H2O2 B.KMnO4 C.HNO3 D.Cl2
A.H2O2 B.KMnO4 C.HNO3 D.Cl2
②加入的Y及调节的pH范围是
A.CuCO3 3.7~4.3 B.CuO 3.7~6.4
C.NaOH 3.7~4.2 D.NH3·H2O 3.7~4.0
常温下Ca(OH)2溶于水达饱和时存在如下平衡: Ca(OH)2(s) Ca(OH)2(aq),Ca(OH)2(aq)
Ca(OH)2(aq),Ca(OH)2(aq) Ca2++2OH— 饱和石灰水的密度为d g/cm3,溶液的pH=12。则该温度下Ca(OH)2的溶解度为
A.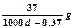 |
B.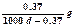 |
C.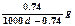 |
D.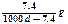 |
已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,且Ksp(AgX)== 1.8×10-10,Ksp(AgY)== 1.0×10-12,Ksp(AgZ)== 8.7×10-17;
(1)根据以上信息,判断AgX、AgY、AgZ三者的溶解度(以被溶解的溶质的物质的量/1L溶液表示)S(AgX)、S(AgY)、S(AgZ)的大小顺序为: _______________
(2)若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-)
(填“增大”、“减小”或“不变”)。
(3)由上述Ksp判断,在上述(2)的体系中,能否实现AgY向AgZ的转化,并简述理由: _______
有关AgCl沉淀的溶解平衡的说法中,不正确的是( )
| A.AgCl沉淀生成和沉淀溶解不断进行,但速率相等 |
| B.AgCl难溶于水,溶液中没有Ag+和Cl- |
| C.升高温度,AgCl沉淀的溶解度增大 |
| D.向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度降低 |
金属氢氧化物在酸中溶解度不同,因此可以利用这一性质, 控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(s,mol·L-1)见图。
(1)pH=3时溶液中铜元素的主要存在形式是: (写化学式)
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH为 (填字母)
A、<1 B、4左右 C、>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质, (能、不能)通过调节溶液pH的方法来除去,理由是
(4)要使氢氧化铜沉淀溶解,除了加入酸之外,还可以 加入氨水,生成[Cu(NH3)4]2+,写出反应的离子方程式。
加入氨水,生成[Cu(NH3)4]2+,写出反应的离子方程式。
(5)已知一些难溶物的溶度积常数如下表。
| 物质 |
FeS |
MnS |
CuS |
PbS |
HgS |
ZnS |
| Ksp |
6.3×10-18 |
2.5×10-13 |
1.3×10-36 |
3.4×10-28 |
6.4×10-53 |
1.6×10-24 |
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的 除去它们的是 。(选填序号)
A、NaOH B、FeS C、Na2S
把Ca(OH)2固体放入一定量的蒸馏水中,有 Ca(OH)2(s) Ca2+(aq)+2OH-(aq),一定温度下达到平衡:当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是
Ca2+(aq)+2OH-(aq),一定温度下达到平衡:当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是
| A.溶液中Ca2+数目增多 | B.溶液中c(Ca2+)增大 |
| C.溶液pH值不变 | D.溶液pH值增大 |