CoCl2·6H2O是一种饲料营养强化剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如下图: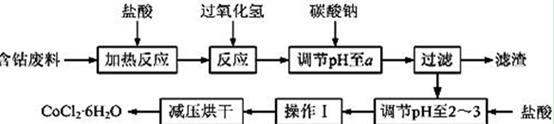
已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
7.6 |
3.4 |
| 完全沉淀 |
4.1 |
9.7 |
9.2 |
5.2 |
请回答下列问题:
(1)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为 
 。
。
(2)加入碳酸钠调节pH至a,a的范围是 ;
(3)操作Ⅰ包含3个基本实验操作,它们是 、 和过滤。
(4)制得的CoCl2·6H2O需减压烘干的原因是 。
(5)为测定产品中CoCl2·6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量。通过计算发现产品中CoCl2·6H2O的质量分数大于100%,其原因可能是 (任写1点)。
已知25℃时,AgC1、AgBr、Agl的Ksp分别为1.8×l0-l0、5.O×10—13、8.3×10—17,用AgNO3标准溶液滴定卤素离子的过程,以滴入AgNO3溶液的体积为横坐标,pX为纵坐标:[pX= -lgc(X )],就可绘得滴定曲线。现以0.1 mol·L-l AgNO3溶液分别滴定20.00 mL 0.1 mol·L-lCl
)],就可绘得滴定曲线。现以0.1 mol·L-l AgNO3溶液分别滴定20.00 mL 0.1 mol·L-lCl 、Br
、Br 、I
、I 绘得滴定曲线如图,下列有关说法中正确的是
绘得滴定曲线如图,下列有关说法中正确的是
A.a、b、c分别表示Cl 、Br 、Br 、I 、I |
B.a、b、c分别表示I 、Br 、Br 、Cl 、Cl |
C.a、b、c分别表示Br 、I 、I 、Cl 、Cl |
D.用硝酸银滴定法测定试样中c(Cl ),可用KI作指示剂 ),可用KI作指示剂 |
CoCl2·6H2O是一种饲料营养强化剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如下图:
已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
7.6 |
3.4 |
| 完全沉淀 |
4.1 |
9.7 |
9.2 |
5.2 |
请回答下列问题:
(1)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为  。
。
(2)加入碳酸钠调节pH至a,a的范围是 ;
(3)操作Ⅰ包含3个基本实验操作,它们是 、 和过滤。
(4)制得的CoCl2·6H2O需减压烘干的原因是 。
(5)为测定产品中CoCl2·6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量。通过计算发现产品中CoCl2·6H2O的质量分数大于100%,其原因可能是 (任写1点)。
下列化学原理的应用,主要用沉淀溶解平衡原理来解释的是( )
①热纯碱溶液洗涤油污的能力强 ②误将钡盐〔BaCl2、Ba(NO3)2〕当作食盐混用后,常用0.5%的Na2SO4溶液解毒 ③溶洞、珊瑚的形成④碳酸钡不能做“钡餐”而硫酸钡则能 ⑤泡沫灭火器灭火的原理
| A.②③④ | B.①②③ | C.③④⑤ | D.①②③④⑤ |
(1)用水稀释0.1mol/L氨水,溶液中随着水量的增加而减小的是_______(填字母)
(2)已知25℃时,Ksp(CaSO4)==7.10×10-5.向0.100L含CaSO4固体的溶液中加入2.22gCaCl2粉末充分搅拌,若溶液的体积变化忽略不计,则溶液中CaSO4固体的质量将______ (填“增大”、“减小”或“不变”,下同), Ksp(CaSO 4)将________。
4)将________。
相同温度下,将足量的AgCl分别放入下列溶液中:
①20mL0.1mol/L(NH4)2CO3溶液 ②40mL0.02 mol/LBaCl2溶液
③40mL0.03 mol/L盐酸 ④10 mL蒸馏水
⑤50 mL0.05mol/LAgNO3溶液。则AgCl的溶解度大小顺序为:
| A.①=②=③=④=⑤ | B.①>④>③>②>⑤ |
| C.⑤>④>①>③>② | D.④>③>⑤>①>② |
已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1) CuSO4 +Na2CO3
主要:Cu2+ + CO32─ + H2O = Cu(OH)2↓+ CO2↑
次要:Cu2+ + CO32─=" " CuCO3↓
(2) CuSO4 +Na2S
主要:Cu2+ + S2─ =" " CuS↓
次要:Cu2+ + S2─+ 2H2O = Cu(OH)2↓+ H2S↑
则下列几种物质的溶解度大小的比较中,正确的是
| A.CuS <Cu(OH)2<CuCO3 | B.CuS >Cu(OH)2>CuCO3 |
| C.Cu(OH)2>CuCO3>CuS | D.Cu(OH)2<CuCO3<CuS |
有关难溶盐的溶度积及溶解度,以下叙述中正确的是
| A.将难溶电解质放入纯水中,溶解达到平衡时,电解质离子浓度的乘积就是该物质的Ksp |
| B.两种难溶电解质,其中Ksp小的溶解度也一定小 |
| C.加入与原电解质具有相同离子的物质,可使难溶盐电解质的溶解度变小,也使Ksp变小 |
| D.向AgCl的悬浊液中加入适量的水,使AgCl再次达到溶解平衡,AgCl的Ksp不变,其溶解度也不变 |
已知:Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=7.8×10-13。现将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,发生的反应为
| A.只有AgBr沉淀 |
| B.AgCl和AgBr沉淀等量生成 |
| C.AgCl和AgBr沉淀都有,AgCl沉淀比AgBr多 |
| D.AgCl和AgBr沉淀都有,AgBr沉淀比AgBr多 |
下列说法中正确的是
| A.饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的pH增大 |
B.AgCl悬浊液中存在平衡:AgCl(s)  Ag+(aq)+Cl-(aq),往其中加入少量NaCl粉末,平衡向左移动,溶液中离子的总浓度会减小 Ag+(aq)+Cl-(aq),往其中加入少量NaCl粉末,平衡向左移动,溶液中离子的总浓度会减小 |
| C.为减小洗涤过程中固体的损失,最好选用稀H2SO4代替H2O来洗涤BaSO4沉淀 |
| D.硬水中含有较多的Ca2+、Mg2+、HCO3-、SO42-,加热煮沸可以完全除去其中的 Ca2+、Mg2+ |
(6分)已知在25℃,AgX、AgY、AgZ均难溶于水,且Ksp(AgX)=1.8×10-10,
Ksp(AgY)=1.0×10-12,Ksp(AgZ)=8.7×10-17。
(1)判断AgX、AgY、AgZ三者的溶解度(用已被溶解的溶质的物质的量/1 L溶液表示)S(AgX)、S(AgY)、S(AgZ)的大小顺序为____________________________。
(2)若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-)________(填“增大”“减小”或“不变”)。
(3)在25℃时,若取0.188 g的AgY(相对分子质量188)固体放入100 mL水中(忽略溶液体积的变化),则溶液中Y-的物质的量浓度为__________________。
(4)由上述Ksp判断,在上述(3)的体系中,________(填“能”或“否”)实现AgY向AgZ的转化,简述理由:________________________________________。
硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
| A.温度一定时,Ksp(SrSO4)随c(SO42—)的增大而减小 |
| B.三个不同温度中,313 K时Ksp(SrSO4)最大 |
| C.283 K时,图中a点对应的溶液是饱和溶液 |
| D.283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液 |
在重铬酸钾(K2Cr2O7)溶液中存在如下平衡:

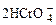

 , 向K2Cr2O7溶液中加入AgNO3溶液,发生离子交换反应,生成砖红色沉淀且溶液的pH下降,则生成的砖红色沉淀为
, 向K2Cr2O7溶液中加入AgNO3溶液,发生离子交换反应,生成砖红色沉淀且溶液的pH下降,则生成的砖红色沉淀为
| A.Ag2O | B.Ag2CrO4 | C.AgHCrO4 | D.Ag2Cr2O7 |
(4分)向100mL 0.018mol/L的AgNO3溶液中加入100mL 0.02mol/L的盐酸,生成沉淀。已知AgCl(s) 的溶度积常数Ksp=c(Ag+)×c(Cl-)=1×10-10。(混合后溶液的体积变化忽略不计)。试计算:
的溶度积常数Ksp=c(Ag+)×c(Cl-)=1×10-10。(混合后溶液的体积变化忽略不计)。试计算:
(1)沉淀生成后溶液中Cl-的浓度。
(2)沉淀生成后溶液中Ag+的浓度。