(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________。
A. KMnO4 B. H2O2 C. Cl2水 D. HNO3
然后再加入适当物质 调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________。
调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________。
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8. 0×10-38,Cu(OH
0×10-38,Cu(OH )2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀
)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀 完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶
完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶 液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)。
液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)。
海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:
 |
| 模拟海水中的离 子  浓度(mol/L) 浓度(mol/L) |
Na+[来 |
Mg2+ |
Ca2+ |
Cl― |
 |
| 0.439 |
0.050 |
0.011 |
0.560 |
0.001 |
注:溶液中某种离子的浓度小于1.0×10-5 mol/L,可认为该离子不存在;
实验过程中,假设溶液体积不变。
已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;
Ksp[Ca(OH)2]=4.68×10-6;Ksp[Mg(OH)2]=5.61×10-12。
下列说法正确的是
A.沉淀物X为CaCO3
B.滤液M中存在Mg2+,不存在Ca2+
C.滤液N中存在Mg2+、Ca2+
D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物
室温时,CaCO3在水中的沉淀溶解平衡曲线如图所示。已知CaCO3的溶度积(室温)为2.8×10-9,下列说法中不正确的是 
| A.x的数值为2×10-5 |
| B.c点时有CaCO3生成 |
| C.加入蒸馏水可使溶液由d点变成 a点 |
| D.b点与d点对应的溶度积相等 |
已知常温下反应①、②、③的平衡常数关系为K1> K3> K2,据此所做以下推测合理的是 ①NH3+H+ NH4+(平衡常数为K1) ②Ag++Cl—
NH4+(平衡常数为K1) ②Ag++Cl— AgCl(平衡常数为K2)
AgCl(平衡常数为K2)
③Ag++2NH3 Ag(NH3)2+(平衡常数为K3)
Ag(NH3)2+(平衡常数为K3)
| A.氯化银可溶于氨水 | B.银氨溶液中加入少量氯化钠有白色沉淀 |
| C.银氨溶液中加入盐酸无明显现象 | D.银氨溶液可在酸性条件下稳定存在 |
30℃时等质量的两 份饱和石灰水,一份冷却到10℃,另一份加入少量氧化钙并保持温度仍是30℃,这两种情况下都不改变的是
份饱和石灰水,一份冷却到10℃,另一份加入少量氧化钙并保持温度仍是30℃,这两种情况下都不改变的是
| A.溶液的质量 | B.氢氧化钙的溶解度 |
| C.溶液中钙离子的数目 | D.溶液中钙离子的物质的量浓度 |
已知氯化银在水中存在沉淀溶解平衡:AgCl Ag+ + Cl-,现将足量的氯化银分别放入下列选项的溶液中,充分搅拌后,相同温度下,银离子浓度最小的是( )
Ag+ + Cl-,现将足量的氯化银分别放入下列选项的溶液中,充分搅拌后,相同温度下,银离子浓度最小的是( )
| A.100mL蒸馏水中 | B.50mL0.1mol•L-1的氯化镁溶液 |
| C.150mL0.1mol•L-1的氯化钠溶液 | D.50mL0.1mol•L-1的氯化铝溶液 |
在[Pb2+]为0.200mol/L的溶液中,若每升加入0.201mol的Na2SO4(设条件不变), 留在溶液中的Pb2+的百分率是(已知PbSO4的Ksp=1.8×10-8)
| A.1×10-3% | B.2×10-4% | C.9×10-3% | D.2.5×10-20% |
(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________。
A. KMnO4 B. H2O2 C. Cl2水 D. HNO3
B. H2O2 C. Cl2水 D. HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________。
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为_____ ___,
___, 通过计算确定上述方案________(填“可行”或“不可行”)。
通过计算确定上述方案________(填“可行”或“不可行”)。
下列说法不正确的是( )
| A.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小; |
| B.沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全; |
C.对于Al(OH)3(s) Al(OH)3(aq) Al(OH)3(aq)  Al3++3OH-,前者为溶解平衡,后者为电离平衡; Al3++3OH-,前者为溶解平衡,后者为电离平衡; |
| D.除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3大 |
下列说法不正确的是__________。
| A.物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的; |
B.对于Al(OH)3(s)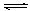 Al(OH)3(aq) Al(OH)3(aq) 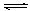 Al3++3OH-,前者为溶解平衡,后者为电离平衡; Al3++3OH-,前者为溶解平衡,后者为电离平衡; |
| C.除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3大 |
| D.沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全。 |
下列叙述正确的是  ( )
( )
| A.0.1 mol/LCH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| B.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 |
| C.在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降 |
| D.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等 |
某温度时,AgCl在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是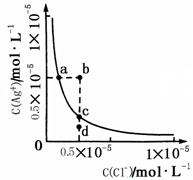
| A.加入NaCl可以使溶液由a点变到b点 |
| B.向AgCl饱和溶液中加入水, C(Ag+)增大 |
| C.d点无AgCl沉淀生成 |
| D.a点对应的Ksp大于c点对应的Ksp |
向饱和的BaSO4溶液中加水,下列叙述正确的是( )
| A.BaSO4溶解度增大,Ksp不变 |
| B.BaSO4溶解度、Ksp均增大 |
| C.BaSO4溶解度不变,Ksp增大 |
| D.BaSO4溶解度、Ksp均不变 |
某温度时,BaSO4在水中的沉淀溶解平衡曲线如下图所示。下列说法正确的是
| A.加入Na2SO4可以使溶液由a点变到b点 |
| B.通过蒸发可以使溶液由d点变到c点 |
| C.d点无BaSO4沉淀生成 |
| D.a点对应的BaSO4的Ksp大于c点对应的Ksp |
已知:Ksp(AgCl)=1×10-10,Ksp(AgI)=1×10-16,Ksp(Ag2CrO4)=8.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( )
| A.AgCl>AgI>Ag2CrO4 | B.AgCl> Ag2CrO4>AgI |
| C.Ag2CrO4> AgCl> >AgI | D.Ag2CrO4> AgI> AgCl |