(1)粗制的CuCl2·2H2O晶体中常含有Fe3+、Fe2+杂质。在提纯时,常先加入合适的氧化剂,将Fe2+氧化为Fe3+,下列可选用的氧化剂是___________。
A.KMnO4 B.H2O2 C.Cl2水 D.HNO3
(2)己知:常温下Ksp[Fe(OH)3]=8.0×10-38,Ksp[Cu(OH)2]=2.2×10-20,㏒2=0.3。通常认为残留在溶液中的离子浓度小于1×10-5mol·L-1时就认为沉淀完全。试计算
①将溶液的pH调至PH=__________时Fe3+转化为Fe(OH)3而沉淀完全。
②若CuSO4溶液的浓度为2.2mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为__________。
(3)调整溶液的pH可选用下列中的____________。
A.NaOH(aq) B.NH3·H2O C.CuO粉末 D.Cu(OH)2悬浊液 E.Cu2(OH)2CO3(s)
向ZnSO4溶液中加入Na2S溶液时,得到白色沉淀,然后向白色沉淀中滴加CuSO4溶液,发现沉淀变为黑色,则下列说法不正确的是
| A.白色沉淀为ZnS,黑色沉淀为CuS |
| B.上述现象说明ZnS的Ksp小于CuS的Ksp |
| C.利用该原理可实现一种沉淀转化为更难溶的沉淀 |
| D.该过程破坏了ZnS的溶解平衡 |
下表是五种银盐的溶度积常数(25℃):
| 化学式 |
AgCl |
Ag2SO4 |
Ag2S |
AgBr |
AgI |
| 溶度积 |
1.8×10-10 |
1.4×10-5 |
6.3×10-50 |
7.7×10-13 |
8.51×10-16 |
下列说法错误的是( )
A.五种物质在常温下溶解度最大的是Ag2SO4
B.将氯化银溶解于水后,向其中加入Na2S,则可以生成黑色沉淀
C.对于AgCl、AgBr和AgI三种物质在常温下的溶解度随着氯、溴、碘的顺序增大
D.沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动
下列说法正确的是( )
①用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小;
②物质的溶解度随温度的升高而增加,物质的溶解都是吸热的;
③对于Al(OH)3(s) Al(OH)3(aq)
Al(OH)3(aq) Al3++3OH-,前者为溶解平衡,后者为电离平衡;
Al3++3OH-,前者为溶解平衡,后者为电离平衡;
④除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3小
⑤沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全。
| A.①②③④⑤ | B.② | C.①③④⑤ | D.①②⑤ |
在溶液中有浓度均为0.01mol·L—1的Fe3+、Cr3+、Mg2+等离子,已知:
Ksp[Fe(OH)3]=2.6×10—39mol4·L—4;Ksp[Cr(OH)3]=7.0×10—31mol4·L—4
Ksp[Zn(OH)2]=1.0×10—17mol3·L—3;Ksp[Mg(OH)2]=1.8×10—11mol3·L—3
当氢氧化物开始沉淀时,下列哪一种离子所需溶液的pH最小
| A.F3+ | B.Cr3+ | C.Zn2+ | D.Mg2+ |
已知,Fe2+结合S2—的能力大于结合OH—的能力,而Al3+则正好相反,I2的氧化性比S强。在Fe2(SO4)3和AlCl3的混合溶液中,先加入过量的KI溶液,再加入足量的Na2S溶液,所得沉淀是( )
| A.FeS、Al(OH)3和S | B.Fe(OH)3和Al(OH)3 |
| C.Fe2S3和 Al(OH)3 | D.Al2S3、FeS和S |
下列说法中,正确的是
| A.难溶电解质在水溶液中达到沉淀溶解平衡时,沉淀和溶解即停止 |
| B.Ksp越小,难溶电解质在水中的溶解能力一定越弱 |
| C.Ksp的大小与离子浓度无关,只与难溶电解质的性质和温度有关 |
| D.相同温度下, AgCl在水中的溶解能力与在NaCl溶液中的相同 |
有关AgCl沉淀的溶解平衡说法正确的是( )
| A.AgCl沉淀生成和沉淀溶解不断进行并且速率相等 |
| B.AgCl难溶于水,溶液中没有Ag+和Cl- |
| C.升高温度,AgCl沉淀的溶解度减小 |
| D.向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解平衡不移动 |
在溶液中有浓度均为0.01mol·L-1的Fe3+、Cr3+、Zn2+、Mg2+等离子,已知:
当氢氧化物开始沉淀时,下列哪一种离子所需溶液的pH最大
| A.Cr3+ | B.Fe3+ | C.Zn2+ | D.Mg2+ |
在温度t1和t2下,X2(g)和H2反应生成HX的平衡常数如下表:
下列说法正确的是
| A.在相同条件下随着卤素原子核电荷数的增加,平衡时X2的转化率逐渐降低 |
| B.t2>t1,HX的生成反应是吸热反应 |
| C.随着卤素原子核电荷数的增加HX的还原性逐渐减弱 |
| D.随着卤素原子核电荷数的增加HX的稳定性逐渐增强 |
已知:
①25℃时弱电解质电离平衡数:Ka(CH3COOH)=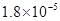 ,Ka(HSCN)=0.1,
,Ka(HSCN)=0.1,
难溶电解质的溶度积常数:Kap(CaF2)=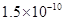
②25℃时,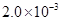 mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示: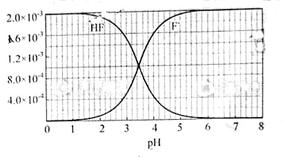
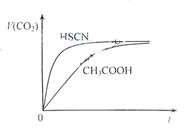
请根据以下信息回答下旬问题: 图2
(1)25℃时,将20mL 0.10 mol·L-1 CH3COOH溶液和20mL 0.10 mol·L-1HSCN溶液分别与20mL 0.10 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为图2所示:
反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是 。反应结束后所得两溶液中,c(CH3COO-) c(SCN-)(填“>”、“<”或“=”)
(2)25℃时,HF电离平衡常数的数值Ka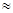 ,列式并说明得出该常数的理由 。
,列式并说明得出该常数的理由 。
(3)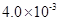 mol·L-1HF溶液与
mol·L-1HF溶液与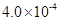 mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),
mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化), 通过列式计算说明是否有沉淀产生。
通过列式计算说明是否有沉淀产生。
(是,否)有沉淀产生
列式计算(过程):
在平衡体系Ca(OH)2(s) Ca2+(aq)+2OH-(aq)中,能使c(Ca2+)减小,而使c(OH-)增大的是( )
Ca2+(aq)+2OH-(aq)中,能使c(Ca2+)减小,而使c(OH-)增大的是( )
| A.加入少量MgCl2固体 | B.加入少量Na2CO3固体 |
| C.加入少量KCl固体 | D.加入少量Ba(OH)2固体 |
某温度时,BaSO4在水中的沉淀溶解平衡曲线 如右图所示。下列说法正确的是
如右图所示。下列说法正确的是 (提示:BaSO4(s)
(提示:BaSO4(s) Ba2+(aq)+SO42-(aq)的平衡
Ba2+(aq)+SO42-(aq)的平衡 常数Ksp=c(Ba2+)·c(SO42-),称为溶积常数)
常数Ksp=c(Ba2+)·c(SO42-),称为溶积常数)
A. 加入Na2SO4可以使溶液由a点变到c点 加入Na2SO4可以使溶液由a点变到c点 |
B. 通过蒸发可以使溶液由d 通过蒸发可以使溶液由d 点变到c点 点变到c点 |
C. d点有BaSO4沉淀生成 d点有BaSO4沉淀生成 |
D. a点对应的Ksp大于c点对应的Ksp a点对应的Ksp大于c点对应的Ksp |
工业上制备氯化铜时,是将浓盐酸用蒸气加热至80℃左右,慢慢加入粗制氧化铜粉末(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下:CuO+2HCl===CuCl2+H2O FeO+2HCl===FeCl2+H2O; 已知:pH≥9.6时,Fe2+以Fe(OH)2形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀 ;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀.除去溶液中的Fe2+,可以采用的方法是
;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀.除去溶液中的Fe2+,可以采用的方法是
| A.直接加碱,调整溶液pH≥9.6 | B.加纯铜粉,将Fe2+还 原出来 原出来 |
| C.先将Fe2+氧化成Fe3+,再调整pH在3~4 | D.通入硫化氢,使Fe2+直接沉淀 |
已知:25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11。下列说法正确的是( )
A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+) 大 大 |
| B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 |
| C.25℃时,Mg(OH)2固体在20 mL 0.01 mol·L-1氨水中的Ksp比在20 mL 0.01 mol·L-1NH4Cl溶液中的Ksp小 |
| D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2 |