将足量的BaCO3粉末分别加入下列溶液中,充分溶解至溶液饱和。各溶液中Ba2+的浓度最小的为
| A.10 mL 0.2 mol/LNa2CO3溶液 | B.40 mL水 |
| C.50 mL 0.01 mol/L 氯化钡溶液 | D.100 mL 0.01 mol/L盐酸 |
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图。下列说法正确的是
| A.常温下,向100mL CaSO4饱和溶液中,加入400mL 0.01mol/LNa2SO4溶液后,溶液中有沉淀析出 |
| B.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3 mol/L |
| C.d点溶液通过蒸发可以变到c点 |
| D.a点对应的Ksp等于c点对应的Ksp |
已知如下物质的溶度积常数FeS:Ksp=6.3×10-18;CuS:Ksp=1.3×10-36;ZnS:Ksp=1.6×10-24.下列说法正确的是
| A.同温度下,CuS的溶解度大于ZnS的溶解度 |
| B.将足量CuSO4溶解在0.1 mol·L-1的H2S溶液中,Cu2+能达到的最大浓度为1.3×10-35 mol·L-1 |
| C.因为H2SO4是强酸,所以Cu2++H2S===CuS↓+2H+不能发生 |
| D.除去工业废水中的Cu2+,可以选用FeS做沉淀剂 |
某温度下,水的离子积常数K 。该温度下,将pH=4的
。该温度下,将pH=4的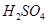 溶液与pH=9的NaOH溶液混合并保持恒温,欲使混合溶液的pH=7,则稀硫酸与NaOH溶液的体积比为( )
溶液与pH=9的NaOH溶液混合并保持恒温,欲使混合溶液的pH=7,则稀硫酸与NaOH溶液的体积比为( )
| A.1∶10 | B.9∶1 | C.1∶9 | D.99∶21 |
下表是不同温度下水的离子积数据:
| 温度/℃ |
25 |
t1 |
t2 |
| Kw/ mol2·L-2 |
1×10-14 |
a |
1×10-12 |
试回答以下几个问题:
(1)若25< t1< t2,则a 1×10-14(填“<”、“>”或“=”),由此判断的理由是:
(2)在25 ℃下,pH=10的NaOH溶液中,水电离产生的[OH-]为:
(3)若某温度下,纯水中c(H+) = 5×10-7 mol·L-1,则此时纯水中的c(OH-)=_______________;若温度不变,滴入稀硫酸使c(H+)=5.0×10-3 mol·L-1,则c(OH-)=_______________。
(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________
A. KMnO4 B. H2O2 C. Cl2水 D. HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH不可选用下列中的________
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图。下列说法正确的是
常温下,向100mL CaSO4饱和溶液中,加入400mL 0.01mol/LNa2SO4溶液后,溶液中有沉淀析出
B.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3 mol/L
C.d点溶液通过蒸发可以变到c点
D.a点对应的Ksp等于c点对应的Ksp
已知如下物质的溶度积常数FeS:Ksp=6.3×10-18;CuS:Ksp=1.3×10-36;ZnS:Ksp=1.6×10-24.下列说法正确的是
| A.同温度下,CuS的溶解度大于ZnS的溶解度 |
| B.将足量CuSO4溶解在0.1 mol·L-1的H2S溶液中,Cu2+能达到的最大浓度为1.3×10-35 mol·L-1 |
| C.因为H2SO4是强酸,所以Cu2++H2S===CuS↓+2H+不能发生 |
| D.除去工业废水中的Cu2+,可以选用FeS做沉淀剂 |
已知氯化银在水中存在沉淀溶解平衡:AgCl Ag+ + Cl-,25℃时氯化银的KSP=1.8×10-10。现将足量的氯化银分别放入下列选项的溶液中,充分搅拌后,相同温度下,银离子浓度最小的是
Ag+ + Cl-,25℃时氯化银的KSP=1.8×10-10。现将足量的氯化银分别放入下列选项的溶液中,充分搅拌后,相同温度下,银离子浓度最小的是
| A.100mL蒸馏水中 | B.50mL0.1mol?L-1的氯化镁溶液 |
| C.100mL0.1mol?L-1的氯化钠溶液 | D.50mL0.1mol?L-1的氯化铝溶液 |
一定温度下的难溶电解质AmBn在水溶液中达到溶解平衡时。已知下表数据
| 物质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
| Ksp/25℃ |
8.0×10-16 |
2.2×10-20 |
4.0×10-38 |
| 完全沉淀时的PH值范围 |
≥9.6 |
≥6.4 |
3~4 |
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不科学的是
A.向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
B.该溶液中c(SO42-):{c(Cu2+)+c(Fe2+)+c(Fe3+)}>5:4
C.向该溶液中加入适量氯水,并调节pH值到3~4后过滤,得到纯净的CuSO4溶液
D.向该溶液中加少量铁粉即能观察到红色固体析出
把Ca(OH)2放入蒸馏水中,一段时间后达到如下平衡:Ca(OH)2(固) Ca2++2OH-,下列说法正确的是( )
Ca2++2OH-,下列说法正确的是( )
| A.给溶液加热,溶液的pH升高 |
| B.恒温下向溶液中加入CaO,溶液的pH升高 |
| C.向溶液中加入Na2CO3溶液,则其中Ca(OH)2的固体增多 |
| D.向溶液中加入少量CH3COONa晶体,则其中Ca(OH)2的固体增多 |
下列有关沉淀溶解平衡的说法中,正确的是( )
A. Ksp(AB2)小于Ksp(CD),说明AB2的溶解度小于CD的溶解度
B.在氯化银的沉淀溶解平衡体系中加入蒸馏水,氯化银的Ksp增大
C.在碳酸钙的沉淀溶解平衡体系中加入稀盐酸,沉淀溶解平衡不移动
D.向氯化银沉淀溶解平衡体系中加人碘化钾固体,氯化银沉淀可转化为碘化银沉淀
I、通过火法冶金炼出的铜是粗铜,含杂质金、银、铁、锌等金属和少量矿物杂质(与酸不反应)。制作电器及其他仪器产品时必须要求是纯铜,为此以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯。
表:几种物质形成沉淀时的pH
| 物质 |
Fe(OH)2 |
Fe(OH)3 |
Zn(OH)2 |
Cu(OH)2 |
| 开始沉淀时的pH |
7.6 |
2.7 |
5.7 |
4.7 |
| 完全沉淀时的pH |
9.7 |
3.7 |
8.5 |
7.3 |
(1)在精炼铜时,阴极电极反应方程式为 ;金、银以单质的形式沉积在电解槽 (填“阳极”或“阴极”)的槽底。
(2)在精炼铜的过程中,Cu2+浓度逐渐降低,c(Fe2+)、c(Zn2+)会逐渐增大,所以需定时除去其中的Fe2+、Zn2+。甲同学设计了如下除杂流程:

|
①试剂a最好选用 (填写序号),加入试剂a的目的是 。
a、氯水 b、高锰酸钾溶液 c、硝酸 d、双氧水| 难溶电解质 |
AgI |
AgOH |
Ag2S |
PbI2 |
Pb(OH)2 |
PbS |
| Ksp |
8.3×10-17 |
5.6×10-8 |
6.3×10-50 |
7.1×10-9 |
1.2×10-15 |
3.4×10-28 |
(1)你认为往废水中投入 (填字母序号)沉淀的效果最好
a、NaOH b、Na2S c、KI d、Ca(OH)2
(2)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=
已知BaCO3和BaSO4均为难溶电解质,其溶度积分别为Ksp(BaCO3)=5.1×10-9 mol2·L-2,Ksp(BaSO4)=1.1×10-10 mol2·L-2,则下列说法中正确的是( )
| A.BaSO4可做钡餐而BaCO3不能是因为Ksp(BaSO4)<Ksp(BaCO3) |
| B.在制腈纶纤维的1 L溶液中含SO42-为1.0×10-3 mol,则加入0.01 mol BaCl2不能使SO42-完全沉淀 |
| C.在清理有关仪器的BaSO4沉淀时,常加入饱和Na2CO3溶液,使BaSO4转化为BaCO3再用酸处理 |
| D.用稀H2SO4洗涤BaSO4效果比用水好,BaCO3也能用此法处理 |