海南省海口市高三高考调研测试地化学试卷
2010年11月,在墨西哥坎昆举行了全球环境气候会议,我国近年在节能减排方面取得的成就受到了肯定。下列减排的气体中,造成地球温室效应的主要气体是
| A.二氧化碳 | B.二氧化硫 | C.氮氧化物 | D.含铅废气 |
设NA表示阿伏加德罗常数,下列说法正确的是
| A.常温常压下,11.2 L氨气中含有的氢原子数为1.5NA |
| B.标准状况下,0.2 mol三氧化硫中含有的氧原子数为0.6NA |
| C.常温下,7.1 g氯气与足量的氢氧化钠溶液反应,转移的电子数为0.2NA |
D.常温下, 1 L 0.1 mol/L AlCl3溶液中含Al3+数为0.1NA 1 L 0.1 mol/L AlCl3溶液中含Al3+数为0.1NA |
下列反应可以发生且符合“强酸制弱酸”规律的是
| A.CuSO4+H2S=CuS↓+H2SO4 | ||
| B.CO2+H2O+(CH3COO)2Ca=2CH3COOH+CaCO3↓ △ |
C.2NaCl+H2SO4(浓)====Na2SO4+2HCl↑ |
D.Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓ |
下列说法中,错误的是
| A.NaHCO3溶液中碳元素主要以HCO3—存在 |
| B.Na2CO3溶液中滴加酚酞呈红色,加热红色变深 |
| C.NH4Cl溶液呈酸性这一事实能说明一水合氨为弱碱 |
| D.在稀醋酸中加醋酸钠固体能促进醋酸的电离 |
锌与稀硝酸反应,若被氧化的锌与被还原的硝酸的物质的量之比为2:1,则该反应的还原产物为
| A.NO | B.N2O | C.NO2 | D.Zn(NO3)2 |
下列化学用语书写正确的是
| A.乙醇的结构简式:C2H6O | B.HCl的电子式: |
C.硫离子的结构示意图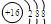 |
D.乙烷的分子式:CH3—CH3 |
能正确表示下列反应的离子方程式的是
| A.硫化氢气体通入足量氢氧化钠溶液中:H2S+2OH—=S2—+2H2O |
| B.铁与足量稀硝酸反应:Fe+2H+=Fe2++H2↑ |
| C.氯化铁溶液与浓氨水反应:Fe3++3OH—=Fe(OH)3↓ |
| D.Al2O3溶于盐酸:Al2O3+6H+ =2Al3++3H2O |
下列有关元素或物质性质的说法正确的是
| A.元素的最高正化合价在数值上一定等于它所在的族序数 |
| B.同周期主族元素的原子半径越小,越难失去电子 |
| C.元素的非金属性越强,它的气态氢化物的沸点越高 |
| D.酸性:HClO4>H2SO4>H3PO4>H2SiO3 |
一定温度下,氢氧化镁的悬浊液中存在下列平衡:Mg(OH)2(s) Mg2+(aq)+2OH—(aq),保持温度不变,向其中加入下列物质,可使悬浊液中氢氧化镁固体质量减少的是
Mg2+(aq)+2OH—(aq),保持温度不变,向其中加入下列物质,可使悬浊液中氢氧化镁固体质量减少的是
| A.H2O | B.MgCl2固体 | C.NaOH 固体 | D.NH4C1固体 |
下图是氨氧燃料电池示意图,按照此图的提示,回答下列问题: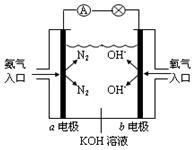
(1)a电极作______极(填“正”、“负”或“阴”、“阳”),其电极反应式为_________________;
(2)反应一段时间后,电解质溶液的PH将 (填“增大”、“减小”或“不变”);
(3)已知N2(g)+3H2(g)=2NH3(g) ΔH=" —92.4" kJ·mol-1;2H2(g)+O2(g)=2H2O(g) ΔH=" —483.6" kJ·mol-1,试写出氨气完全 燃烧生成气态水的热化学方程式:__________________________;
燃烧生成气态水的热化学方程式:__________________________;
(4)若用该燃料电池产生的电能在铁皮上镀锌(制白铁皮),某铁皮上现需要镀上97.5g锌,理论上至少需要消耗氨气_________L(标准状况)。
已知反应:CO(g) + H2O(g) H2(g) + CO2(g) ΔH=" Q" kJ·mol-1,其平衡常数随温度的变化如下表:
H2(g) + CO2(g) ΔH=" Q" kJ·mol-1,其平衡常数随温度的变化如下表:
| 温度/℃ |
400 |
500 |
850 |
| 平衡常数 |
9.9 4 4 |
9 |
1 |
请回答下列问题:
(1)上述可逆反应中Q 0(填“大于”或“小于”)。
(2)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g)发生上述反应,CO和H2O(g)浓度变化如下图。试回答:
①0~4 min的平均反应速率v(CO)="______" mol/(L·min)
②下列表述能作为该可逆反应达到平衡标志的是__________(填序号)。
A.当混合气体的密度保持不变时
B.当反应消耗0.1molCO(g) 同时也生成0.1molH2O(g)时
C.当CO(g)的质量分数保持不变时
D.当该反应的ΔH不变时
(3)若要加快该反应速率,同时还要提高CO的转化率,可采取的措施为_____(填序号)。
A.增加水蒸气的量 B.降低温度
C.使用催化剂 D.增大压强 E.不断移走CO2
由短周期元素组成的X、Y、Z、M是中学化学常见的四种物质,它们有如图所示的转化关系,请根据题意回答问题。
(1)若X、Y、Z含有同种常见金属元素,M是O2。X为___________;Z与氢气在一定条件下化合生成一种产物,写出该反应的化学方程式________。
(2)若X、Y、Z含有同种常见非金属元素,气体Z能使品红溶液褪色。
①X的电子式为__________________ _______;
_______;
②Z与过量的氢氧化钠溶液反应的离子方程式是:_____________________________。
(3)若X的水溶液显碱性,X、M 均为气体,上述转化过程均在水溶液中进行。任写一个满足上述转化过程Y→Z反应的化学方程式______________________。
均为气体,上述转化过程均在水溶液中进行。任写一个满足上述转化过程Y→Z反应的化学方程式______________________。
A、B、C均为有机物,且 1mol B与碳酸氢钠反应生成2mol的二氧化碳。A、B、C有如图所示的转化关系: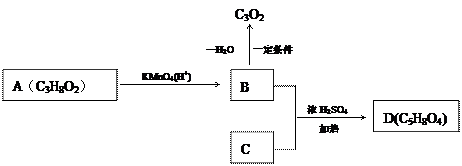
试回答:
(1)写出A的结构简式________________________;
(2)写出B与C按物质的量之比1:1反应生成D的化学方程式_____________________,反应类型为 ;
(3)写出C3O2的结构式 。
某化学兴趣小组为了探究锌与硫酸反应的产物,选用了12mol/L的硫酸50ml与过量的锌在加热条件下反应,对硫酸的还原产物进行确定检验。
(1)提出假设。根据所学的知识,他们对硫酸的还原产物提出了三种假设:
假设1:_________________________________;
假设2:_________________________________;
假设3:有SO2与H2 两种气体。
(2)设计实验方案证明假设。小组为了证明假设3,选用了如图所示的仪器与药品,按气流由左至右的方向,仪器的接口顺序为a→
(仪器与药品可重复使用)。
(3)实验过程。根据(2)中的实验方案进行实验。依据所给仪器和条件,要证明有H2产生,应采用的实验操作方法是___________________________________________。
(4)实验结论。通过上述实验,证明确有SO2与H2 两种气体产生。请你从理论上给予合理的解释:_______________________________________________________。
(5)反应停止后,将烧瓶中的液体过滤,滤液用水稀释,加入足量的BaCl2溶液,充分反应后过滤,得到81.55g沉淀。则在该实验中生成的SO2与H2的体积比为__________(同温同压)。
(I)多项选择题
在一定条件下,烯烃可发生臭氧氧化还原水解反应,生成羰基化合物,该反应可表示为: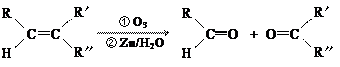
 已知某有机物发生臭氧氧化还原水解反应后的产物为 CH3COCH2
已知某有机物发生臭氧氧化还原水解反应后的产物为 CH3COCH2 CHO,则该有机物可能是 。
CHO,则该有机物可能是 。
(II)
A~G都是有机化合物,它们的转化关系如下: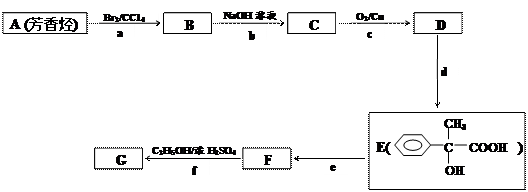
请回答下列问题:
(1)已知:有机物G的蒸气与甲烷的相对密度为11,取0.1mol的G完全燃烧生成48.4gCO2和10.8gH2O,则G的分子式是 ;
(2)写出B的结构简式 ;
(3)上述反应中属于取代反应的是 (填代号);
(4)由E生成F的反应条件是 ;
(5)由C生成D的化学方程式是 ;
(6)同时满足下列两个条件的E的同分异构体共有  种,其中苯环上的一氯代物有两种同分异构体的是 (填结构简式)。
种,其中苯环上的一氯代物有两种同分异构体的是 (填结构简式)。
①分子内除了苯环外无其他环状结构,且苯环上有2个取代基;
②1mol该同分异构体与NaOH溶液反应时,可消耗3mol的NaOH。
(I)多项选择题
下列说法中正确的是 。
| A.SO2和O3、PO43—和C1O4—互为等电子体 |
| B.甲烷分子失去一个H+,形成CH3—,其碳原子的杂化类型发生了改变 |
| C.Ti原子的核外电子排布式为[Ar]3d34s2 |
| D.CS2、H2O、C2H2都是直线型分子 |
E.CH4、BCl3、CO2都是含有极性键的非极性分子
(II)
立方氮化硼 是一种自然界不存在的人工合成超硬材料,硬度仅次于金刚石,是超硬材料领域的最重要成就之一。请回答下列问题:
是一种自然界不存在的人工合成超硬材料,硬度仅次于金刚石,是超硬材料领域的最重要成就之一。请回答下列问题:
(1)在第二周期,原子的第一电离能一般随核电荷数的增大而逐渐 ,比较下列原子的第一电离能:Be B,N O(填“>”“<”),其原因是 。
(2)下图为立方氮化硼的晶胞,则氮化硼的化学式为 ,该晶体中B原子填充N原子的 空隙。若该晶胞的边长为a cm,那么该晶体的密度为 g/cm3
(只要求列出算式)。
(3)立方氮化硼的晶体结构与金刚石的结构相似,但其熔点比金刚石的低,试分析其原因
。
(4)立方氮化硼由六方氮化硼在高温高压下制备,六方氮化硼又称“白石墨”,结构和许多性质与石墨相似,六方氮化硼中N原子的杂化轨道类型为 ,请在上方的方框中画出六方氮化硼的平面结构示意图(用“○”代表N原子,用“●”代表B原子,每种原子不少于7个)。
(I)多项选择题
下列关于水处理的说法正确的是 。
| A.FeSO4·7H2O是常用的混凝剂,它除去悬浮固体颗粒的过程只是物理过程 |
| B.用纯碱和生石灰处理硬水,既可以除去暂时硬度,也可以除去永久硬度 |
| C.永久硬度的水可以采用离子交换法进行软化,其主要就是利用了离子交换膜技术 |
| D.污水处理中的三级处理是采用化学方法,对污水进行深度处理和净化 |
E.电 渗析法是一种常用的海水淡化的方法,使用到的离子交换膜只有阳离子交换膜
渗析法是一种常用的海水淡化的方法,使用到的离子交换膜只有阳离子交换膜
(II)
下列是工业合成氨的简要流程示意图: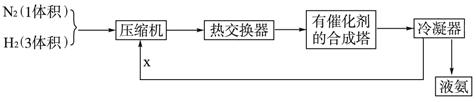
请回答下列问题:
(1)H2通常用碳氢化合物与水反应,写出有关的反应方程式 ,从冷凝器回流到压缩机中的X是 。
(2)比较工业上合成氨和SO2的催化氧化反应,其生产条件有哪些异同,并解释原因
。
(3)将N2、H2按体积比1∶3进入合成塔,从合成塔出来的混合气中,氨的体积分数为15%,则H2的体积分数为______________。
(4)NH3的用途之一是制造化肥,但在化肥的使用过程中要注意铵态氮肥不可以和草木灰混用,解释其原因 。
(5)NH3是一种重要的化工原料,除了制造化肥之外,再列举出两种NH3的用途
。
 的是
的是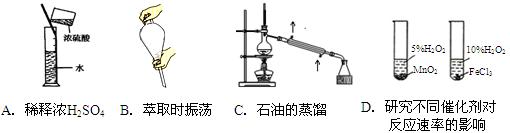
 粤公网安备 44130202000953号
粤公网安备 44130202000953号