平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题小组以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵矾: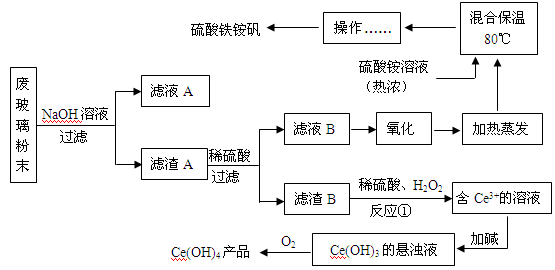
已知:
Ⅰ.酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce3+易水解,Ce4+有较强氧化性;
Ⅱ.CeO2不溶于稀硫酸;
Ⅲ.硫酸铁铵矾[Fe2(SO4) 3·(NH4) 2SO4·24H2O]广泛用于水的净化处理。
(1)滤液A的主要成分 (填写化学式)。
(2)写出反应①的离子方程式 。
(3)反应①之前要洗涤滤渣B,对滤渣B进行洗涤的实验操作方法是 。
(4)稀土元素的提纯,还可采用萃取法。已知化合物HT作为萃取剂能将铈离子从水溶液中萃取出来,过程表示为Ce2(SO4)3 (水层)+ 6HT(有机层) 2CeT3 (有机层)+3H2SO4(水层) ,分液得到CeT3 (有机层),再加入H2SO4 获得较纯的含Ce3+的水溶液。可选择硫酸作反萃取剂的原因是 。
2CeT3 (有机层)+3H2SO4(水层) ,分液得到CeT3 (有机层),再加入H2SO4 获得较纯的含Ce3+的水溶液。可选择硫酸作反萃取剂的原因是 。
(5)用滴定法测定制得的Ce(OH)4产品纯度。
所用FeSO4溶液在空气中露置一段时间后再进行滴定,则测得该Ce(OH)4产品的质量分数 。(填“偏大”、“偏小”或“无影响”)
(6)已知Fe3+沉淀的pH范围:2.2~3.2,Fe2+沉淀的pH范围:5.8~7.9,Zn2+沉淀的pH范围:5.8~11.0,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。现用FeSO4溶液(含有ZnSO4杂质)来制备硫酸铁铵矾。实验中可选用的试剂: KMnO4溶液、30%H2O2、 NaOH溶液、饱和石灰水、稀H2SO4溶液、稀盐酸。
实验步骤依次为:
①向含有ZnSO4杂质的FeSO4溶液中,加入足量的NaOH溶液至pH>11, ;
② ;
③向②中得到的溶液中加入硫酸铵溶液, ,过滤、洗涤、常温晾干,得硫酸铁铵晶体(NH4) Fe(SO4)2·12H2O。
工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下: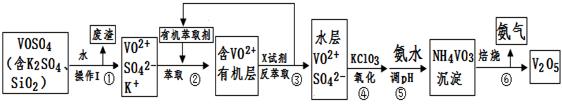
请回答下列问题:
(1)步骤①所得废渣的成分是 (写化学式),操作I的名称 。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n (水层)+ 2nHA(有机层)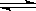 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是 。
③中X试剂为 。
(3)⑤的离子方程式为 。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH |
1.3 |
1.4 |
1.5 |
1.6 |
1.7 |
1.8 |
1.9 |
2.0 |
2.1 |
| 钒沉淀率% |
88.1 |
94.8 |
96.5 |
98.0 |
98.8 |
98.8 |
96.4 |
93.1 |
89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为 ;
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< 。
(已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39)
(5)该工艺流程中,可以循环利用的物质有 和 。
(15分)氮的氢化物NH3、N2H4等在工农业生产、航空航天等领域有广泛应用。
(1)已知25℃时,几种难溶电解质的溶度积如下表所示:
| 氢氧化物 |
Cu(OH)2 |
Fe(OH)3 |
Fe(OH)2 |
Mg(OH)2 |
| Ksp |
2.2×10-20 |
4.0×10-38 |
8.0×10-16 |
1.8×10-11 |
向Cu2+、Mg2+、Fe3+、Fe2+浓度都为0.01mol·L-1的溶液中缓慢滴加稀氨水,产生沉淀的先后顺序为 (用化学式表示)。
(2)实验室制备氨气的化学方程式为 。
工业上,制备肼(N2H4)的方法之一是用次氯酸钠溶液在碱性条件下与氨气反应。以石墨为电极,将该反应设计成原电池,该电池的负极反应为 。
(3)在3 L密闭容器中,起始投入4 mol N2和9 mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如表所示:
| 温度(K) |
平衡时NH3的物质的量(mol) |
| T1 |
2.4 |
| T2 |
2.0 |
已知:破坏1 mol N2(g)和3 mol H2(g)中的化学键消耗的总能量小于破坏2 mol NH3(g)中的化学键消耗的能量。
①则T1 T2(填“>”、“<”或“=”)。
②在T2 K下,经过10min达到化学平衡状态,则0~10min内H2的平均速率v(H2)= ,平衡时N2的转化率α(N2)= 。若再增加氢气浓度,该反应的平衡常数将 (填“增大”、“减小”或“不变”)。
③下列图像分别代表焓变(△H)、混合气体平均相对分子质量( )、N2体积分数φ(N2)和气体密度(ρ)与反应时间关系,其中正确且能表明该可逆反应达到平衡状态的是 。
)、N2体积分数φ(N2)和气体密度(ρ)与反应时间关系,其中正确且能表明该可逆反应达到平衡状态的是 。
锂被誉为“金属味精”,以LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源。工业上常以β锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂。其中一种工艺流程如下:
已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
| 氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
| 开始沉淀pH |
2.7 |
3.7 |
9.6 |
| 完全沉淀pH |
3.7 |
4.7 |
11 |
②Li2CO3在不同温度下的溶解度如下表:
| 温度/℃ |
0 |
10 |
20 |
50 |
75 |
100 |
| Li2CO3的溶解度/g |
1.539 |
1.406 |
1.329 |
1.181 |
0.866 |
0.728 |
请回答下列问题:
(1)用氧化物形式表示LiAlSi2O6的组成:__________________________。
(2)反应Ⅱ加入碳酸钙的作用是__________________________________。
(3)写出反应Ⅲ中生成沉淀A的离子方程式:________________________。
(4)洗涤所得Li2CO3沉淀要使用________(选填“热水”或“冷水”),你选择的理由是__________________________________。
(5)电解熔融氯化锂生产锂时,阳极产生的氯气中会混有少量氧气,原因是
________________________________________。
Ⅰ.下表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
请回答下面问题:
(1)下列能使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是 (填序号)。
| A.升高温度 | B.加水稀释 |
| C.加少量的CH3COONa固体 | D.加少量冰醋酸 |
(2)CH3COONH4的水溶液呈 (选填“酸性”、“中性”、“碱性”)。
(3)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使c(SO42-)达到0.0l mol/L以上,则溶液中c(CO32-)应不低于 mol/L。
Ⅱ.化学在能源开发与利用中起着重要的作用,如甲醇、乙醇、二甲醚(CH3OCH3)等都是新型燃料。
(1)乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇。
2CO2(g)+6H2(g)  CH3CH2OH(g)+3H2O(g) △H=a kJ/mol
CH3CH2OH(g)+3H2O(g) △H=a kJ/mol
在一定压强下,测得上述反应的实验数据如下表。
根据表中数据分析:
①上述反应的 0(填“大于”或“小于”)。
0(填“大于”或“小于”)。
②在一定温度下,提高氢碳(即 )比,平衡常数K值 (填“增大”、“减小”、或“不变”)。
)比,平衡常数K值 (填“增大”、“减小”、或“不变”)。
(2)催化剂存在的条件下,在固定容积的密闭容器中投入一定量的CO和H2,同样可制得乙醇(可逆反应)。该反应过程中能量变化如图所示:
①写出CO和H2制备乙醇的热化学反应方程式 。
②在一定温度下,向上述密闭容器中加入1 mol CO、3 mol H2及固体催化剂,使之反应。平衡时,反应产生的热量为Q kJ,若温度不变的条件下,向上述密闭容器中加入4 mol CO、12 mol H2及固体催化剂,平衡时,反应产生的热量为w kJ,则w的范围为 。
(3)二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、高效的优良性能。以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池,其工作原理与甲烷燃料电池原理相类似。该电池中负极上的电极反应式是 。
铁、氯、铜及其化合物在生产、生活中有广泛的用途,试回答下列问题。
(1)二氧化氯(C1O2)已逐步代替C12用于自来水处理,用C1O2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(C1O2-)。已知:25℃时Ka(HClO)=3.2×10-8,Ka(HClO2)=1.0×10-2,则酸性强弱关系为 ;在pH=5的上述处理过的饮用水中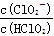 = 。若饮用水中C1O2-的含量超标,可向其中加入适量的Fe2+将C1O2-还原成Cl一,写出酸性条件下该反应的离子方程式: 。
= 。若饮用水中C1O2-的含量超标,可向其中加入适量的Fe2+将C1O2-还原成Cl一,写出酸性条件下该反应的离子方程式: 。
(2)①腐蚀铜板后的溶液中,若Cu2+、Fe3+和Fe2+浓度均为0.1 mol/l,如图为金属离子的浓度的对数与溶液pH的关系,现向混合溶液中通入氨气调节溶液的pH=5.6时,溶液中存在的金属阳离子为 。(当溶液中金属离子浓度≤10-5mol/l时,可认为沉淀完全)。
②从图中数据计算可得Fe(OH)2的溶度积Ksp[Fe(OH)2] 。
②Na2S是常用的沉淀剂。某工业污水中含有等浓度的
Cu2+、Fe2+、Pb2+,滴加Na2S溶液后首先析出的沉淀是 ;当最后一种离子沉淀完全时(该离子浓度为10-5m01/l),此时的S2一的浓度为 。
已知:Ksp(FeS)=6.3×10-18(mol•L-1)2,Ksp(CuS)=6×10-36(mol•L-1)2,Ksp(PbS)=2.4×10-28(mol•L-1)2
Ⅰ、回答下列问题
1)、已知常温下,在NaHSO3溶液中c(H2SO3 ) < c(SO32-),且H2SO3的电离平衡常数为K1=1.5×10-2
K2=1.1×10-7;氨水的电离平衡常数为K=1.8×10-2;则等物质的量浓度的下列五种溶液:①NH3·H2O ②(NH4)2CO3 ③KHSO3 ④KHCO3 ⑤Ba(OH)2,溶液中水的电离程度由大到小排列顺序为_____________
2)、NaHSO3具有较强还原性可以将碘盐中的KIO3氧化为单质碘,试写出此反应的离子反应方程式_______________________________________
3)、在浓NH4Cl溶液中加入镁单质,会产生气体,该气体成分是_________________,用离子方程式表示产生上述现象的原因:__________________
Ⅱ、已知25 ℃时Ksp[Mg(OH)2]=5.6×10-12,Ksp[Cu(OH)2]=2.2×10-20,
Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33
(1)①在25 ℃下,向浓度均为0.1 mol·L-1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式)。
②用MgCl2、AlCl3的混合溶液(A) 与过量氨水(B) 反应,为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入________(填“A”或“B”),再滴加另一反应物。
(2)溶液中某离子物质的量浓度低于1.0×10-5 mol·L-1时,可认为已沉淀完全。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+完全沉淀时,测定c(Al3+)=0.2 mol·L-1。此时所得沉淀中________(填“还含有”或“不含有”)Al(OH)3。请写出计算过程____________________________________
根据下列流程处理废旧电路板来回收金属Cu,并制得高铁酸钾(K2 FeO4)。
据此回答问题:
(1)试剂a最好为 ,试剂b为 (填写所选试剂代号)
| A.浓硫酸 | B.硫酸铁溶液 | C.氯水 | D.H2O2和稀硫酸 E.Fe |
(2)溶液Z中金属离子可能有Cu2+、Fe2+、Fe3+,检验Fe3+的试剂为 (填化学式);欲测定溶液Z中Fe2+的浓度,需要用 (填主要仪器名称)配制500ml 0.1mol/L的KMnO4标准溶液进行滴定,在滴定时KMnO4标准溶液应加入到____________(填“酸式”或“碱式”)滴定管中,滴定终点时的现象是 。
(3)溶液Y的水溶液显 性,原因是 (用离子方程式表示)。
(4)K2FeO4是强氧化剂,目前水处理通常用K2FeO4理由是 。
生成K2FeO4的离子方程式是
(5)室温时向Fe2(SO4)3溶液中滴加NaOH溶液,若要使Fe3+完全沉淀,则所需溶液的pH值至少为 (已知Ksp(Fe(OH)3=1.0×10-38 )
硫酸铜在化工和农业方面有很广泛的用处,某化学兴趣小组查阅资料,用两种不同的原料制取硫酸铜。
方式一:一种含铜的矿石(硅孔雀石矿粉),含铜形态为CuCO3·Cu(OH)2和CuSiO3·2H2O(含有SiO2、FeCO3、Fe2O3、Al2O3等杂质)。以这种矿石为原料制取硫酸铜的工艺流程如下图:
请回答下列问题:
⑴完成步骤①中稀硫酸与CuSiO3·2H2O发生反应的化学方程式
CuSiO3·2H2O+H2SO4=CuSO4 +________+H2O;
⑵步骤②调节溶液pH选用的最佳试剂是__________________
A. CuO B. MgO C. FeCO3 D NH3·H2O
⑶有关氢氧化物开始沉淀和完全沉淀的pH如下表:
| 氢氧化物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
| 开始沉淀的pH |
3.3 |
1.5 |
6.5 |
4.2 |
| 沉淀完全的pH |
5.2 |
3.7 |
9.7 |
6.7 |
由上表可知:当溶液pH=4时,不能完全除去的离子是________。
⑷滤液B通过蒸发浓缩(设体积浓缩为原来的一半)、冷却结晶可以得到CuSO4·5H2O晶体。某同学认为上述操作会伴有硫酸铝晶体的析出。请你结合相关数据对该同学的观点予以评价(已知常温下,Al2(SO4)3 饱和溶液中C(Al3+)=2.25mol·L-1,Ksp[Al(OH)3]=3.2×10-34) ________(填“正确”或“错误”)。
方式二:以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
Ⅱ.采用如下装置进行电化学浸出实验,将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
2RH(有机相)+ Cu2+(水相) R2Cu(有机相)+ 2H+(水相)
R2Cu(有机相)+ 2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ.电解硫酸铜溶液制得金属铜。
(5)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2 + 4H+ = Cu2+ + Fe2+ + 2H2S 2Fe3+ + H2S = 2Fe2+ + S↓+ 2H+
电解过程中,阳极区Fe3+的浓度基本保持不变,原因是____________________(用电极反应式表示)。
(6)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是_____________ 。
(7)步骤Ⅳ,若电解0.1mol CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是 ____ 。
研究人员研制利用低品位软锰矿浆(主要成分是MnO2)吸收硫酸厂的尾气SO2,制备硫酸锰的生产流程如下:
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。PbO2的氧化性大于MnO2。PbSO4是一种微溶物质。有关金属离子的半径、形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图。
| 离子 |
离子半径(pm) |
开始沉淀 时的pH |
完全沉淀 时的pH |
| Fe2+ |
74 |
7.6 |
9.7 |
| Fe3+ |
64 |
2.7 |
3.7 |
| Al3+ |
50 |
3.8 |
4.7 |
| Mn2+ |
80 |
8.3 |
9.8 |
| Pb2+ |
121 |
8.0 |
8.8 |
| Ca2+ |
99 |
- |
- |

请回答下列问题:
(1)写出浸出过程中生成Mn2+反应的化学方程式 。
(2)氧化过程中主要反应的离子方程式 。
(3)在氧化后的液体中加入石灰浆,用于调节pH值,此处调节pH值用到的仪器是 ,应调节pH的范围为 。
(4)阳离子吸附剂可用于除去杂质金属离子。请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有 、 等;吸附步骤除去的主要离子为: 。
(5)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10—6。现将c mol·L—1CaCl2溶液与2.00×10—2 mol·L—1Na2SO4溶液等体积混合(忽略体积的变化),则生成沉淀时,c的最小值是 。
二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产ClO2的工艺主要包括:①粗盐精制;②电解微酸性NaCl溶液;③ClO2的制取。工艺流程如下图: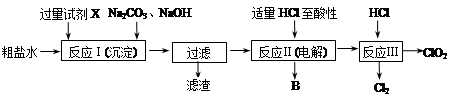
(1)粗食盐水中含有Ca2+、Mg2+、SO42-等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,X是 (填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO42-,其原因是 。(已知:Ksp(BaSO4)=1.1×10-10;Ksp(BaCO3)=5.1×10-9)
(2)上述过程中,将食盐水在特定条件下电解得到的氯酸钠与盐酸反应生成ClO2。电解时生成的气体B是 ;反应Ⅲ的化学方程式为 。
(3)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知:ClO2+I-+H+—I2+Cl-+H2O 未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知:I2+2S2O32-=2I-+S4O62-)
① 准确量取10.00 mL ClO2溶液的玻璃仪器是 。
② 滴定过程中,至少须平行测定两次的原因是 。
③ 根据上述步骤可计算出原ClO2溶液的物质的量浓度为 mol·L-1(用含字母的代数式表示)。
A是有机羧酸盐,B、C、D是常见化合物; A、B、C、D焰色反应呈黄色,水溶液均呈碱性,其中B的碱性最强。X、Y是最常见的氧化物且与人体、生命息息相关,它们的晶体类型相同。A与B等物质的量反应生成D和一种气体单质;C受热分解得到Y、D和X;B与C反应生成D和X。E由两种元素组成,式量为83,将E投入X中得到B和气体Z,Z在标准状况下的密度为0.76g·L-1。
(1)A的化学式是 。Y的电子式是 。
(2)X的沸点比同主族同类型物质要高,原因是 。
(3)写出E与足量盐酸反应的化学方程式
(4)写出在D的饱和溶液中不断通Y析出C的离子方程式 。
(5)A的一个重要应用是根据2A →P +H2↑得到P,P溶液中的阴离子通常用CaCl2使之沉淀,当它完全沉淀时,溶液中Ca2+的物质的量浓度至少为 。
(沉淀Ksp=2.3×10-9,当溶液中离子浓度≤10-5mol·L-1,即可认为完全沉淀)
(6)实验室常用P与足量HCl反应所得的有机物在浓硫酸条件下共热分解制某还原性气体,设计实验证明分解产物中还原性气体的存在 。
氧化铝(Al2O3) 和氮化硅(Si3N4)是优良的高温结构陶瓷,在工业生产和科技领域有重要用途。
(1)Al与NaOH溶液反应的离子方程式为 。
(2)下列实验能比较镁和铝的金属性强弱的是 (填序号)。
a.测定镁和铝的导电性强弱
b.测定等物质的量浓度的Al2(SO4)3和MgSO4溶液的pH
c.向0.1 mol/LAlCl3和0.1 mol/L MgCl2中加过量NaOH溶液
(3)铝热法是常用的金属冶炼方法之一。
已知:4Al (s)+3O2(g) =2Al2O3(s) ΔH1 =" -3352" kJ/mol
Mn(s)+ O2(g) =MnO2 (s) ΔH2 =" -521" kJ/mol
Al与MnO2反应冶炼金属Mn的热化学方程式是 。
(4)氮化硅抗腐蚀能力很强,但易被氢氟酸腐蚀,氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,其反应方程式为 。
(5)工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g) + 2N2(g) + 6H2(g) Si3N4(s) + 12HCl(g) △H<0
Si3N4(s) + 12HCl(g) △H<0
某温度和压强条件下,分别将0.3mol SiCl4(g)、0.2mol N2(g)、0.6mol H2(g)充入2L密闭容器内,进行上述反应,5min达到平衡状态,所得Si3N4(s)的质量是5.60g。
①H2的平均反应速率是 mol/(L·min)。
②若按n(SiCl4) : n(N2) : n(H2) =" 3" : 2 : 6的投料配比,向上述容器不断扩大加料,SiCl4(g)的转化率应 (填“增大”、“减小”或“不变”)。
(6)298K时,Ksp[Ce(OH)4]=1×10—29。Ce(OH)4的溶度积表达式为Ksp= 。
为了使溶液中Ce4+沉淀完全,即残留在溶液中的c(Ce4+)小于1×10-5mol·L-1,需调节pH为 以上。
铬污染主要产生于铬矿的开采和冶炼。工厂排出的铬渣成分为SiO2、 A12O3、MgO、 Fe2O3、Na2Cr2O7等,其中危害最大的化学成分是Na2Cr2O7。已知:① Na2Cr2O7易溶于水,是强氧化剂。② +6价铬易被人体吸收,可致癌;+3价铬不易被人体吸收,毒性小。下面是实验室模拟处理铬渣、消除铬污染的工艺流程如下(部分操作和条件略):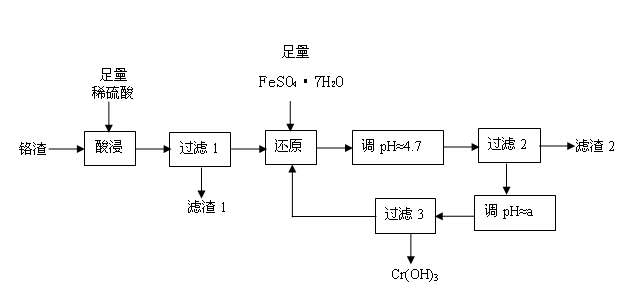
(1)在酸浸过程中,稀H2SO4溶解A12O3的离子方程式是 。
(2)过滤1后的滤液中存在如下平衡:Cr2O72-(橙色)+ H2O  2CrO42-(黄色)+ 2H+,此时溶液应呈现的颜色是 。
2CrO42-(黄色)+ 2H+,此时溶液应呈现的颜色是 。
(3)用FeSO4·7H2O还原 Na2Cr2O7的离子方程式是 。
(4)已知:生成氢氧化物沉淀的pH
| 物质 |
Fe(OH)3 |
Al(OH)3 |
Cr(OH)3 |
Fe(OH)2 |
Mg(OH)2 |
| 开始沉淀 |
1.5 |
3.4 |
4.9 |
6.3 |
9.6 |
| 完全沉淀 |
2.8 |
4.7 |
5.5 |
8.3 |
12.4 |
根据表中数据,流程中的a为 。
(5)分离滤渣2中物质,发生反应的离子方程式是 。
(6)过滤3所得滤液又回流到过滤1所得滤液中,其目的是 。
四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意图如下: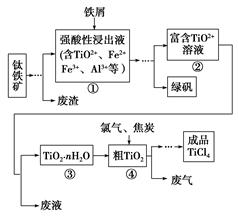
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
Fe+2Fe3+=3Fe2+
2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
加入铁屑的作用是 。
(2)在②→③工艺过程中需要控制条件以形成TiO2·nH2O溶胶,该溶胶的分散质颗粒直径大小在 范围。
(3)若把③中制得的固体TiO2·nH2O用酸清洗除去其中的杂质,还可制得钛白粉。已知25 ℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+ Fe3++3H2O的平衡常数K= 。
Fe3++3H2O的平衡常数K= 。
(4)已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式: 。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是 (只要求写出一项)。
(6)依据下表信息,要精制含少量SiCl4杂质的TiCl4,可采用 方法。
| |
TiCl4 |
SiCl4 |
| 熔点/℃ |
-25.0 |
-68.6 |
| 沸点/℃ |
136.4 |
57.6 |