(原创) 酸、碱、盐均属于电解质,它们的水溶液中存在各种平衡。
(1) 氨水是中学常见碱
① 下列事实可证明氨水是弱碱的是 (填字母序号)。
A.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁
B.常温下,0. 1 mol·L-1氨水pH为11
C.铵盐受热易分解
D.常温下,0. 1mol·L-1氯化铵溶液的pH为5
② 下列方法中,可以使氨水电离程度增大的是 (填字母序号)。
A.通入氨气 B.加入少量氯化铁固体
C.加水稀释 D.加入少量氯化铵固体
(2)盐酸和醋酸是中学常见酸
用0.1 mol·L-1NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
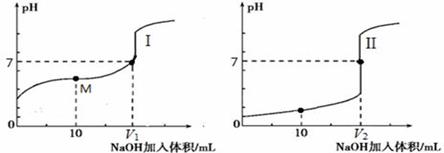
① 滴定醋酸的曲线是 (填“I”或“II”)。
② 滴定开始前,三种溶液中由水电离出的c(H+)最大的是 。
③V1和V2的关系:V1 V2(填“>”、“=”或“<”)。
④ M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是
(3)为了研究难溶盐的沉淀溶解平衡和沉淀转化,某同学设计如下实验。
| 步骤1:向2 mL 0.005 mol·L-1AgNO3溶液中加入2 mL 0.005 mol·L-1 KSCN溶液,静置。 |
出现白色沉淀。 |
| 步骤2:取1 mL上层清液于试管中,滴加1滴2 mol·L-1Fe(NO3)3溶液。 |
溶液变为红色。 |
| 步骤3:向步骤2的溶液中,继续加入5滴 3 mol·L-1 AgNO3溶液。 |
现象a ,溶液红色变浅。 |
| 步骤4:向步骤1余下的浊液中加入5滴 3 mol·L-1 KI溶液。 |
出现黄色沉淀。 |
已知:ⅠAgSCN是白色沉淀。
Ⅱ相同温度下,Ksp(AgI)= 8.3×10‾17,Ksp (AgSCN )= 1.0×10‾12 。
① 步骤3中现象a是 。
② 用沉淀溶解平衡原理解释步骤4的实验现象 。
③向50 mL 0.005 mol•L‾1的AgNO3溶液中加入150 mL0.005 mol•L‾1的 KSCN溶液,混合后溶液中Ag+的浓度约为 mol•L‾1。(忽略溶液体积变化)
锰的化合物是优良的催化剂,可用于干电池原料生产等。
(1)锌锰干电池的反应为2MnO2 +Zn+2NH4Cl ="2" MnO(OH) +Zn(NH3)2Cl2,MnO(OH)中锰元素的化合价为____。
(2)向废电池还原后的废液(含有Mn2+、Fe2+、Zn2+等)中逐滴滴加Na2S溶液,最先生成的沉淀为 (填化学式)。[已知Ksp(MnS)=1.4×10-1 5,Ksp(ZnS)=2.9×10 -25,Ksp(FeS)=6.0×10-18]
(3) Mn2+催化H2O2分解:2H2O2(l)=2H2O(l)+O2(g) △H1,其反应机理如下:
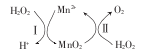
①已知反应Ⅱ为MnO2(s)+H2O2(1) +2H+( aq)=Mn2+(aq) +O2(g)+2H2O(1) △H2。写出反应I的热化学方程式(焓变用△H1和△H2表示): 。
②某温度时,向10 mL0.4 mol.L-1 H2O2液中滴入1滴MnSO4发生分解:2H2O2 =2H2O+O2,测得不同时刻生成O2的体积(已折算为标准状况下的体积)如下表:

0~2 min时反应速率比2~4 min时的快,其原因是_________;
0~6 min的平均反应速率v(H2O2)= (忽略溶液体积的变化)。
(4)锰基催化剂是合成甲醇、二甲醚的催化剂。已知:

①反应I的正反应是 (填“放热”或“吸热”)反应。
②反应Ⅱ的平衡常数表达式为 。
以下是25℃时几种难溶电解质的溶解度:
| 难溶电解质 |
Mg(OH)2 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| 溶解度/g |
9×10-4 |
1.7×10-6 |
1.5×10-4 |
3.0×10-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质离子。例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可。
请回答下列问题:
(1)上述三种除杂方案都能够达到很好的效果,Fe2+、Fe3+都被转化为_______(填化学式)而除去。
(2)①中加入的试剂应该选择_________为宜,其原因是_____________。
(3)②中除去Fe3+所发生的离子方程式为__________________________。
(4)下列与方案③相关的叙述中,正确的是__________________(填字母,多选不得分,少选得1分)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在
连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。
(1)连二次硝酸中氮元素的化合价为_____________________。
(2)常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1的H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。
①写出H2N2O2在水溶液中的电离方程式:______________。
②b点时溶液中c(H2N2O2)_____(填“>”、“<”或 “=”,下同)c(N2O22-)。
③a点时溶液中c(Na+)____c(HN2O2-)+c(N2O22-)。
(3)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中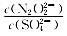 =______。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
=______。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
回答下列问题。
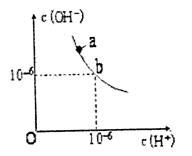
(1)如右图,某温度(t℃)时水的图像如下,a点离子积KW=__________mol2·L-2;该温度下,pH=12的NaOH与pH=2的H2SO4等体积混合,溶液显_________性。
(2)25℃时,向0.1mol·L-1氨水中加入少量NH4Cl固体,当固体溶解后,测得溶液pH__________,NH+4的物质的量浓度________。(填增大、减小或不变)
(3)体积相等的稀NaOH和CH3COOH溶液混合,若溶液中c(Na+)=c(CH3COO-),则该溶液显______(填“酸性”、“碱性”、“中性”),则混合前c(NaOH)___________C(CH3COOH)(填“>”、“<”或“=”)。
(4)常温时,Fe(OH)3的Ksp=1×10-38,要使溶液中的Fe3+沉淀完全(残留在溶液中的c(Fe3+)<10-5mol·L-1),则溶液的pH最小为___________。
(5)用可溶性碳酸盐,可以浸取CaSO4固体,则溶液浸取过程中会发生反应:
CaSO4(s)+CO2-3(aq)  CaCO3(s)+SO2-4(aq)。
CaCO3(s)+SO2-4(aq)。
已知298K时,KSP(CaCO3)=2.80×10-9, KSP(CaSO4)=4.90×10-5,则此温度下该反应的平衡常数K为_________(计算结果保留三位有效数字)。
碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
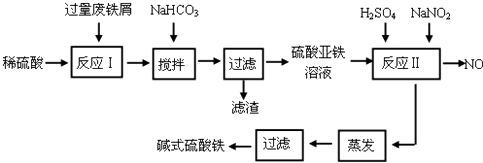
回答下列问题:
(1)如何加快废铁屑的溶解,写出两种办法_____________________。
(2)加入少量NaHCO3的目的是调节pH在_________________范围内。
(3)反应Ⅱ中加入NaNO2的目的是__________________。
(4)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+聚合离子,该水解反应的离子方程式为_________________。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为_______________。
A.氯水 B.KSCN溶液 C.酸性KMnO4溶液 D.NaOH溶液
(6)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<2,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000mol/L Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:2Fe3++2I-═2Fe2++I2 I2+2S2O32-═2I-+S4O62-
则溶液中铁元素总含量为g/L。若滴定前溶液中H2O2没除尽,所测定的铁元素的含量将会____________(填“偏高”“偏低”“不变”)。
CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:
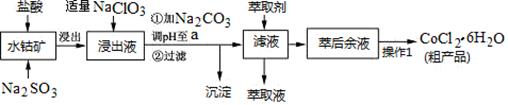
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
Mn(OH)2 |
| 开始沉淀 |
2.7 |
7.6 |
7.6 |
4.0 |
7.7 |
| 完全沉淀 |
3.7 |
9.6 |
9.2 |
5.2 |
9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式________________________。
(2)写出NaClO3发生反应的主要离子方程式_____________________________;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式___________________________。
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为 。
(4)“操作1”中包含3个基本实验操作,它们依次是_________、__________和过滤。制得的CoCl2·6H2O在烘干时需减压烘干的原因是__________________。
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂 的目的是_________;其使用的最佳pH范围是________________。

A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5
锶(38Sr)元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与20Ca和56Ba同属于第ⅡA族。
(1)碱性:Sr(OH)2 Ba(OH)2(填“>”或“<”);锶的化学性质与钙和钡类似,
用原子结构的观点解释其原因是 。
(2)碳酸锶是最重要的锶化合物。用含SrSO4和少量BaSO4、BaCO3、FeO、Fe2O3、Al2O3、SiO2的天青石制备SrCO3,工艺流程如下(部分操作和条件略):
Ⅰ.将天青石矿粉和Na2CO3溶液充分混合,过滤;
Ⅱ.将滤渣溶于盐酸,过滤;
Ⅲ.向Ⅱ所得滤液中加入浓硫酸,过滤;
Ⅳ.向Ⅲ所得滤液中先加入次氯酸,充分反应后再用氨水调pH约为7,过滤;
Ⅴ.向Ⅳ所得滤液中加入稍过量NH4HCO3,充分反应后,过滤,将沉淀洗净,烘干,得到SrCO3。
已知:ⅰ.相同温度时的溶解度: BaSO4<SrCO3<SrSO4<CaSO4
ⅱ.生成氢氧化物沉淀的pH
| 物质 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀pH |
1.9 |
7.0 |
3.4 |
| 完全沉淀pH |
3.2 |
9.0 |
4.7 |
①Ⅰ中,反应的化学方程式是 。
②Ⅱ中,能与盐酸反应溶解的物质有 。
③Ⅳ的目的是 。
④下列关于该工艺流程的说法正确的是 。
a.该工艺产生的废液含较多的NH4+、Na+、Cl-、SO42-
b.Ⅴ中反应时,升高温度一定可以提高SrCO3的生成速率
c.Ⅴ中反应时,加入NaOH溶液一定可以提高NH4HCO3的利用率
(1)室温下,Ksp(BaSO4)=1.1×10-10,将pH=9 的 Ba(OH)2溶液与 pH=4 的 H2SO4溶液混合,若所得混合溶液的 pH=7,则 Ba(OH)2溶液与 H2SO4溶液的体积比为 。欲使溶液中c(SO42-)≤1.0×10-5mol·L-1,则应保持溶液中 c(Ba2+) ≥ mol·L-1。
(2)一定温度下,向1 L 0.1 mol·L-1CH3COOH溶液中加入0.1 molCH3COONa固体,则醋酸的电离平衡向 (填“正”或“逆”)反应方向移动;溶液中 的值 (填“增大”、“减小”或“不变”)。
的值 (填“增大”、“减小”或“不变”)。
(3)已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5
b.CH3COOH+NaHCO3 = CH3COONa+CO2↑+H2O 室温下,CH3COONH4溶液呈 性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈 性。NH4HCO3溶液中物质的量浓度最大的离子是 (填化学式)。
工业制硝酸经以下一系列反应: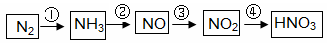
请回答:
(1)写出反应④的化学方程式 ,实验室收集NO的方法是 。
(2)对于氮的化合物,下列说法不正确的是(选填序号字母) 。
a.氨可用作制冷剂
b.铵态氮肥一般不能与碱性化肥共同使用
c.硝酸可用于制化肥、农药、炸药、染料、盐类等
d.某浓硝酸中含有溶质2mol,标准状况下,该浓硝酸与足量的铜完全反应能生成1mol NO2
(3)已知:H2(g)+1/2 O2(g)=H2O(g) △H1=-241.8kJ/mol
N2(g)+ 3H2(g)=2NH3(g) △H2=-92.0kJ/mol
则34g氨气与氧气反应生成N2(g)与H2O(g)时,△H= kJ/mol。
(4)氨气在微生物的作用下与氧气反应生成HNO2,写出该反应的化学方程式 。
(5)氨气是氮肥工业的重要原料,某化肥厂生产铵态氮肥(NH4)2SO4的部分工艺流程如下: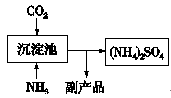
向装有CaSO4悬浊液的沉淀池中先通氨气,再通CO2的原因(请从溶解度和溶解平衡角度分析) 。
减少污染、保护环境是全世界最热门的课题。
(1)为了减少空气中SO2的排放,常采取的措施有:
将煤转化为清洁气体燃料。
已知:H2(g)+1/2O2(g)==H2O(g) ΔH1=-241.8 kJ·mol-1
C(s)+1/2O2(g)===CO(g) ΔH2=-110.5 kJ·mol-1
则焦炭与水蒸气反应生成CO的热化学方程式为:_________________________。
(2)CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2H2(g)  CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图所示。
CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图所示。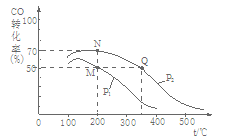
①M、N两点平衡状态下,容器中总物质的物质的量之比为:n(M)总:n(N)总= 。
②若M、N、Q三点的平衡常数KM、KN、KQ的大小关系为 。
(3)电化学降解NO—的原理如图所示,电源正极为 (填“a”或“b”);若总反应为4NO3-+4H+ 5O2↑+2N2↑+2H2O,则阴极反应式为_________________。
5O2↑+2N2↑+2H2O,则阴极反应式为_________________。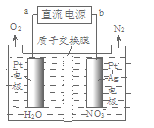
(4)已知25 ℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp(CaF2)=1.5×10-10。现向1000 L 1.5×10-2mol/L CaCl2溶液中通入氟化氢气体,当开始出现白色沉淀时,通入的氟化氢为____________ mol(保留3位有效数字)。
铁及其化合物在日常生活、生产中应用广泛。
(1)某温度下,Ksp(FeS)=8.1×10-17,FeS饱和溶液中c(H+)与c(S2-)之间存在关系:
c2(H+)·c(S2-)=1.0×10-22,为了使溶液里c(Fe2+)达到1 mol·L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的pH约为________(填字母)。
A.2 B.3 C.4 D.5
(2)氧化铁红颜料跟某些油料混合,可以制成防锈油漆。以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下: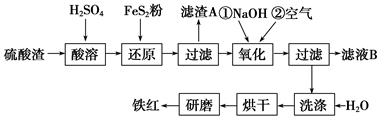
①酸溶过程中Fe2O3发生反应的离子方程式为_____________;“滤渣A”主要成分的化学式为_______________。
②还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式: FeS2+____Fe3++______===______Fe2++____SO42-+______
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为________________________。
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是3.2~3.8。
| 沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Fe(OH)2 |
Mg(OH)2 |
| 开始沉淀pH |
2.7 |
3.8 |
7.6 |
9.4 |
| 完全沉淀pH |
3.2 |
5.2 |
9.7 |
12.4 |
如果pH过大,可能引起的后果是____________________(几种离子沉淀的pH见上表)。
⑤滤液B可以回收的物质有________(填序号)。
A.Na2SO4 B.Al2(SO4)3 C.Na2SiO3 D.MgSO4
以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,用化学沉降法处理含砷废水,相关数据如下表。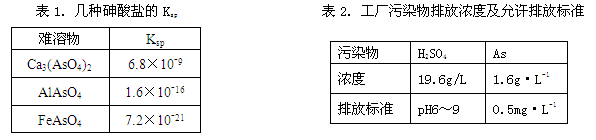
回答以下问题:
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)= mol·L-1。
(2)写出难溶物Ca3(AsO4)2的Ksp表达式:Ksp[Ca3(AsO4)2]= ,若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4mol·L-1,c(AsO43-)的最大是 mol·L-1。
(3)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),写出该反应的离子方程式 。
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为 ;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为 。
K2CO3有广泛的用途。
(1)钾肥草木灰中含有K2CO3、K2SO4、KCl等。将草木灰用水浸取,过滤、蒸发得浓缩液。
①该浓缩液呈碱性的原因用离子方程式表示为 。
②检验该浓缩液中Cl-所用的试剂有 。
| A.AgNO3溶液 |
| B.硝酸 |
| C.盐酸 |
| D.Ba(NO3)2溶液 |
E.BaCl2溶液
(2)工业上曾利用如下反应生产碳酸钾:K2SO4 + C + CaCO3 → K2CO3+ X+ CO2↑(未配平)
已知X为两种元素组成的化合物,则X的化学式为 ;反应中氧化剂与还原剂物质的量之比为 。
(3)离子膜电解-炭化法是目前生产碳酸钾的常用的方法。
第一步:精制KCl溶液
粗KCl中含有Ca2+、Mg2+等离子,按以下流程精制: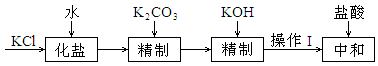
已知:加入K2CO3后,溶液中部分Mg2+转化为MgCO3沉淀。
Ksp[Mg(OH)2]=5.6×10-12,Ksp(CaCO3)=2.8×10-9,Ksp(MgCO3)=6.8×10-6。
①操作Ⅰ的名称是 。
②当加入KOH后,溶液中n(CO32-)增大,主要原因是 。
第二步:电解精制后的KCl溶液制取KOH,其它产物制取盐酸。
第三步:将KOH与CO2反应转化为KHCO3,再将KHCO3分解得到产品。
③离子膜电解-炭化法的整个过程中,可以循环利用的物质有 。
铁是目前人类使用量最大的金属,它能形成多种化合物。
(1)取5.6 g的生铁与足量的稀硫酸混合反应,无论怎样进行实验,最终收集了的气体体积均小于2.24 L(标准状况),最主要的原因是__________________________,所得溶液在长时间放置过程中会慢慢出现浅黄色,试用离子方程式解释这一变化的原因______________________________________。
(2)硫化亚铁常用于工业废水的处理。已知:25℃时,溶度积常数Ksp(FeS)=6.3×10-18、Ksp(CdS)= 3.6×10-29。请写出用硫化亚铁处理含Cd2+的工业废水的离子方程式__________________________。
(3)ZnFe2O3.5是一种新型纳米材料,可将工业废气中的某些元素转化为游离态,制取纳米ZnFe2O3.5和用于除去废气的转化关系为:ZnFe2O4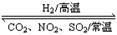 ZnFe2O3.5
ZnFe2O3.5
上述转化反应中消耗的n(ZnFe2O4)︰n(H2)=_______。请写出 ZnFe2O3.5与NO2反应的化学方程式_______________________________。
(4)LiFePO4(难溶于水)材料被视为最有前途的锂离子电池材料之一。
①以FePO4(难溶于水)、Li2CO3、单质碳为原料在高温下制备LiFePO4,该反应的化学方程式为2FePO4+Li2CO3+2C=2LiFePO4+3CO↑。则1molC参与反应时转移的电子数为_______________。
②磷酸铁锂动力电池有几种类型,其中一种(中间是锂离子聚合物的隔膜,它把正极与负极隔开)工作原理为FePO4+Li LiFePO4。则充电时阳极上的电极反应式为______________________________。
LiFePO4。则充电时阳极上的电极反应式为______________________________。
(5)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,此温度下若在实验室中配制5 mol/L 100 mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入_______ml、2 mol/L的盐酸(忽略加入盐酸体积)。