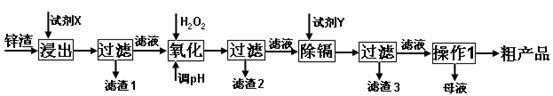
A是有机羧酸盐,B、C、D是常见化合物; A、B、C、D焰色反应呈黄色,水溶液均呈碱性,其中B的碱性最强。X、Y是最常见的氧化物且与人体、生命息息相关,它们的晶体类型相同。A与B等物质的量反应生成D和一种气体单质;C受热分解得到Y、D和X;B与C反应生成D和X。E由两种元素组成,式量为83,将E投入X中得到B和气体Z,Z在标准状况下的密度为0.76g·L-1。
(1)A的化学式是 。Y的电子式是 。
(2)X的沸点比同主族同类型物质要高,原因是 。
(3)写出E与足量盐酸反应的化学方程式
(4)写出在D的饱和溶液中不断通Y析出C的离子方程式 。
(5)A的一个重要应用是根据2A →P +H2↑得到P,P溶液中的阴离子通常用CaCl2使之沉淀,当它完全沉淀时,溶液中Ca2+的物质的量浓度至少为 。
(沉淀Ksp=2.3×10-9,当溶液中离子浓度≤10-5mol·L-1,即可认为完全沉淀)
(6)实验室常用P与足量HCl反应所得的有机物在浓硫酸条件下共热分解制某还原性气体,设计实验证明分解产物中还原性气体的存在 。
相关知识点
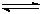 CH3OH(g)。图1表
CH3OH(g)。图1表 示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。


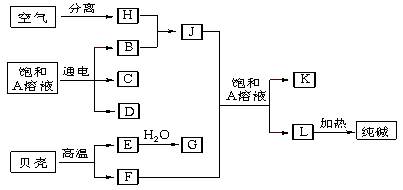
 在标准状况下体积为 L
在标准状况下体积为 L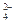 、NO3-、OH-
、NO3-、OH-
 粤公网安备 44130202000953号
粤公网安备 44130202000953号