北京市顺义区高三第一次统练考试化学试卷
下列物质的有效成分及用途对应不正确的是
| |
A |
B |
C |
D |
| 物质 |
沼气 |
漂白液 |
单晶硅 |
食醋 |
| 有效成分 |
CH4 |
NaClO |
Si |
CH3COOH |
| 用途 |
做燃料 |
做消毒剂 |
做光导纤维 |
做调味剂 |
下列各组实验现象可用同一原理解释的是
| A.品红溶液中分别通入SO2和Cl2,品红均褪色 |
| B.溴水分别滴入植物油和裂化汽油中,溴水均褪色 |
| C.浓硫酸和浓盐酸长期暴露在空气中浓度都会降低 |
| D.鸡蛋白溶液中分别加入NaCl溶液和CuCl2溶液,均有固体析出 |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.0.1mol/L KMnO4溶液:K+、Na+、I-、Cl- |
| B.能溶解Al2O3的溶液:Na+、K+、HCO3-、NO3- |
| C.加入KSCN显红色的溶液:K+、Mg2+、Cl-、SO42- |
| D.水电离出c(OH-)=10-5mol/L的溶液:Na+、Fe2+、Cl-、NO3- |
下列实验操作不能达到预期目的的是
| |
实验目的 |
操作 |
| A |
欲比较水和乙醇中羟基氢的活泼性 |
用金属钠分别与水和乙醇反应 |
| B |
欲证明CH2=CHCHO中含有碳碳双键 |
滴加酸性KMnO4溶液,看紫红色是否褪去 |
| C |
欲确定磷、砷两元素非金属性的强弱 |
测定同温同浓度的Na3PO4和Na3AsO4水溶液的pH |
| D |
欲除去苯中混有的苯酚 |
向混合液中加入NaOH溶液,充分反应后,分液 |
下列解释事实的离子方程式正确的是
A.铁和稀硝酸反应制得浅绿色溶液:Fe+ 4H+ + NO3- Fe3+ + NO↑+ 2H2O Fe3+ + NO↑+ 2H2O |
B.实验室盛碱液的瓶子不用玻璃塞:SiO2 + 2OH-  SiO32-+ H2O SiO32-+ H2O |
C.用稀盐酸和大理石反应制取CO2:CO32- + 2H+  CO2↑ + H2O CO2↑ + H2O |
D.向Ca(ClO)2溶液中通入过量CO2制取次氯酸: 2ClO-+ H2O + CO2 2HClO + CO32- 2HClO + CO32- |
短周期元素R、T、Q、W、G在元素周期表中的相对位置如下图所示,其中Q是无机非金属材料的主角。下列判断正确的是
| |
|
R |
|
|
| T |
Q |
|
W |
G |
A.离子半径:T< W< G
B.最简单气态氢化物的热稳定性:Q < R
C.最高价氧化物对应水化物的酸性:Q >W>G
D.T和G组成的化合物甲溶于水,其水溶液呈中性
下列陈述Ⅰ、Ⅱ均正确并且有因果关系的是
| 选项 |
陈述Ⅰ |
陈述Ⅱ |
| A |
Fe2O3是红棕色粉末 |
Fe2O3常用作红色涂料 |
| B |
SiO2是两性氧化物 |
SiO2可和HF反应 |
| C |
Al2O3难溶于水 |
Al2O3可用作耐火材料 |
| D |
SO2有氧化性 |
SO2可使溴水褪色 |
设NA表示阿伏加德罗常数的值,下列说法不正确的是
| A.15 g C2H6含C—H键数目为3NA |
| B.28 g乙烯与丙烯的混合气体,含碳原子总数为2NA |
| C.标准状况下,11.2 L O2与足量Na加热反应,转移电子总数为NA |
| D.铜与浓H2SO4反应,当转移电子数为NA时,收集SO2体积为11.2 L |
下列实验能达到相应目的的是
| A.用图①装置制取并收集氨气 | B.用图②装置制取和收集乙烯 |
| C.用图③装置制备氢氧化亚铁 | D.用图④装置制取乙酸乙酯 |
某有机物M是合成药物的中间体,其结构如下图所示,下列说法不正确的是
| A.M属于芳香族化合物 |
| B.M的分子式为C14H19O3Cl |
| C.1 mol M最多能消耗3 mol NaOH |
| D.M能发生取代、加成、消去反应 |
将下图所示实验装置的K闭合,下列判断正确的是
| A.Zn电极上发生还原反应 |
| B.片刻后盐桥中的Cl-向乙装置中移动 |
| C.片刻后在a点滴加酚酞观察到滤纸变红色 |
| D.片刻后在b点滴加淀粉碘化钾溶液观察到滤纸无变化 |
常温下,浓度均为0.1 mol/L 的下列四种盐溶液,其pH测定如下表所示:
| 序号 |
① |
② |
③ |
④ |
| 溶液 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
下列说法正确的是
A.四种溶液中,水的电离程度①>②>④>③
B.Na2CO3和NaHCO3溶液中,粒子种类相同
C.将等浓度的CH3COOH和HClO溶液比较,pH小的是HClO
D.Na2CO3溶液中, c(Na+) = c(CO32-)+c(HCO3-)+c(H2CO3)
下列根据实验操作和现象所得出的结论不正确的是
| 选项 |
实验操作 |
实验现象 |
结论 |
| A |
向淀粉溶液中加入稀H2SO4,加热几分钟后,冷却再加入新制Cu(OH)2浊液,加热 |
没有红色沉淀生成 |
淀粉没有水解成葡萄糖 |
| B |
灼烧一小块铝箔 |
熔化的铝并不滴落 |
Al2O3的熔点高于Al |
| C |
用洁净的铂丝蘸取化合物X少许,放在酒精灯外焰上灼烧 |
火焰呈黄色 |
X一定含钠元素 |
| D |
向Mg(OH)2悬浊液中滴加少量FeCl3溶液 |
出现红褐色沉淀 |
Mg(OH)2溶解度大于Fe(OH)3 |
常温下,用 0.1000 mol/L NaOH溶液滴定 20.00mL 0.1000 mol/L CH3COOH溶液所得滴
定曲线如图。下列说法不正确的是
| A.a点所示溶液中:c(Na+)=c(CH3COOH) + c(CH3COO-) |
| B.b和c点所示溶液中:c(OH-)-c(H+)=c(Na+)-c(CH3COO-) |
| C.d点所示溶液中:c(Na+) >c(CH3COO-) >c(OH-) >c(H+) |
| D.滴定过程中可能出现:c(CH3COOH) >c(CH3COO-) >c(H+)> c(Na+)>c(OH-) |
某酯K是一种具有特殊香气的食用香料,广泛应用于食品和医疗中。其合成路线如下:
已知:
(1)E的含氧官能团名称是 。
(2)试剂X是 (填化学式);②的反应类型是 。
(3)D的电离方程式是 。
(4)F的分子式为C6H6O,其结构简式是 。
(5)W的相对分子质量为58,1 mol W完全燃烧可产生3.0 mol CO2和3.0 mol H2O,且
W的分子中不含甲基,为链状结构。⑤的化学方程式是 。
(6)G有多种属于酯的同分异构体,请写出同时满足下列条件的所有同分异构体的结构简式: 。
① 能发生银镜反应且能与饱和溴水反应生成白色沉淀
② 苯环上只有两个取代基且苯环上的一硝基取代物只有两种
乙醇汽油含氧量达35%,使燃料燃烧更加充分,使用车用乙醇汽油,尾气排放的CO和碳氢化合物平均减少30%以上,有效的降低和减少了有害的尾气排放。但是汽车使用乙醇汽油并不能减少NOx的排放,对NOx的有效消除成为环保领域的重要课题。NOx排入空气中,形成酸雨,造成空气污染。NOx中有一种红棕色气体,其溶于水的方程式是 。
(2)已知NO2和N2O4的结构式分别是 和
和 。
。
| 物质 |
NO2 |
N2O4 |
|
| 化学键 |
N=O |
N—N |
N=O |
| 键能(kJ/mol) |
466 |
167 |
438 |
写出NO2转化N2O4的热化学方程式 。
(3)研究人员在汽车尾气系统中装置催化转化剂,可有效降低NOx的排放。
① 写出用CO还原NO生成N2的化学方程式 。
② 在实验室中模仿此反应,在一定条件下的密闭容器中,测得NO转化为N2的转化率随温度变化情况和n (NO)/n(CO)比例变化情况如下图。
为达到NO转化为N2的最佳转化率,应该选用的温度和n(NO)/n(CO)比例分别为 、 ;该反应的∆H 0(填“>”、“<”或“=”)。
(4)用 CxHy(烃)催化还原NOx也可消除氮氧化物生成无污染的物质。CH4与NO发生反应的化学方程式为 。
A~E五种元素中,除E外均为短周期元素,且原子序数依次增大。它们的原子
结构或性质如下表所示:
| 元素 |
A |
B |
C |
D |
E |
| 结构或性质 |
原子半径最小的元素 |
地壳中含量最多的元素 |
可与B形成阴阳离子个数比为1:2的两种化合物 |
与B同主族 |
单质是生活中最常见的金属,可被磁铁吸引 |
(1)元素D在周期表中的位置为 。
(2)C与B形成原子个数比为1∶1的化合物中,含有的化学键类型为 。
(3)化合物甲、乙是由A、B、C、D四种元素中的三种组成的强电解质,且两种物质水溶液均显碱性。若甲能抑制水的电离,乙能促进水的电离,则化合物甲的电子式为 ;乙的化学式是 。
(4)以E构成的单质为Y极,碳棒为X极,在6 mol/L的NaOH溶液中进行电解,制取高效净水剂Na2YO4(溶液呈紫红色)。其装置如图。电解过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色,且Y电极变细;电解液澄清。Y极发生的电极反应为:4OH--4e- 2H2O+O2↑和 。若在X极收集气体672 mL,在Y极收集气体168 mL(均已折算为标况下体积),则Y电极质量减少 g。
2H2O+O2↑和 。若在X极收集气体672 mL,在Y极收集气体168 mL(均已折算为标况下体积),则Y电极质量减少 g。
(5)Se是人体必备的微量元素,与B、D同一主族。Se的原子序数为34,且B、D、Se元素气态单质分别与H2反应生成1 mol气态氢化物的反应热如下:
a.+ 29.7 kJ/mol b.-20.6 kJ/mol c.-241.8 kJ/mol
表示生成1 mol H2Se的反应热是 (填序号);依据是: 。
甲醇是一种可再生的优质燃料,用途广泛,研究其作用具有广阔前景。
(1)已知在常温常压下,测得反应的反应热如下:
① 2CH3OH(l)+ 3O2(g)  2CO2(g) +4H2O(g) ∆H1= -1275.6 kJ/mol
2CO2(g) +4H2O(g) ∆H1= -1275.6 kJ/mol
② 2CO(g) +O2(g)  2CO2(g) ∆H2=-566.0 kJ/mol
2CO2(g) ∆H2=-566.0 kJ/mol
CH3OH不完全燃烧生成CO和气态水的热化学方程式是 。
(2)工业上生产甲醇的反应如下:CO2(g) + 3H2(g)  CH3OH(g)+ H2O(g) ∆H = -49 kJ/mol
CH3OH(g)+ H2O(g) ∆H = -49 kJ/mol
在某温度下,容积均为1 L的A、B两个容器中,按不同方式投入反应物,保持恒温恒容。容器B中经10 s后达到平衡。达到平衡时的有关数据如下表:
| 容器 |
A |
B |
| 反应物投入量 |
1 mol CO2(g)和3 mol H2(g) |
1 mol CH3OH(g)和1 mol H2O(g) |
| 反应能量变化 |
放出αkJ热量 |
吸收19.6 kJ热量 |
①从反应开始至达到平衡时,容器B中CH3OH的平均反应速率为 。
②该温度下,B容器中反应的化学平衡常数的数值为 。
③α= 。
④下列措施能使容器A中甲醇的产率增大的是 。
a.升高温度 b.将水蒸气从体系分离
c.用更有效的催化剂 d.将容器的容积缩小一半
(3)我国科学院化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池。甲醇燃料电池的工作原理如下图所示。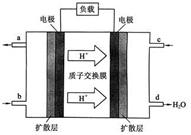
① 该电池工作时,b口通入的物质为 。
② 该电池正极的电极反应式为 。
铬污染主要产生于铬矿的开采和冶炼。工厂排出的铬渣成分为SiO2、 A12O3、MgO、 Fe2O3、Na2Cr2O7等,其中危害最大的化学成分是Na2Cr2O7。已知:① Na2Cr2O7易溶于水,是强氧化剂。② +6价铬易被人体吸收,可致癌;+3价铬不易被人体吸收,毒性小。下面是实验室模拟处理铬渣、消除铬污染的工艺流程如下(部分操作和条件略):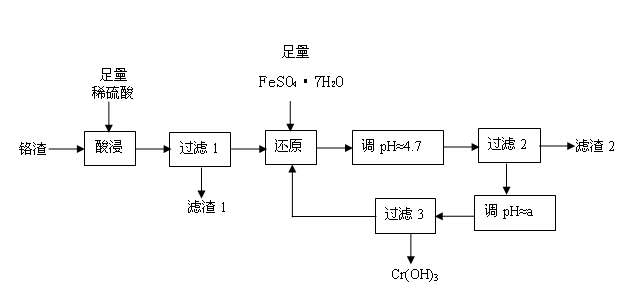
(1)在酸浸过程中,稀H2SO4溶解A12O3的离子方程式是 。
(2)过滤1后的滤液中存在如下平衡:Cr2O72-(橙色)+ H2O  2CrO42-(黄色)+ 2H+,此时溶液应呈现的颜色是 。
2CrO42-(黄色)+ 2H+,此时溶液应呈现的颜色是 。
(3)用FeSO4·7H2O还原 Na2Cr2O7的离子方程式是 。
(4)已知:生成氢氧化物沉淀的pH
| 物质 |
Fe(OH)3 |
Al(OH)3 |
Cr(OH)3 |
Fe(OH)2 |
Mg(OH)2 |
| 开始沉淀 |
1.5 |
3.4 |
4.9 |
6.3 |
9.6 |
| 完全沉淀 |
2.8 |
4.7 |
5.5 |
8.3 |
12.4 |
根据表中数据,流程中的a为 。
(5)分离滤渣2中物质,发生反应的离子方程式是 。
(6)过滤3所得滤液又回流到过滤1所得滤液中,其目的是 。
某课外小组学生对Cl2与FeBr2溶液反应进行实验探究。
| 操 作 |
现 象 |
| 取0.1 mol/L的FeBr2溶液10 mL,测溶液的pH |
pH试纸变红(约为4) |
 |
ⅰ.开始通入100 mL(折合标准状况),溶液由浅绿色逐渐变黄; ⅱ.稍后,继续通入Cl2,溶液黄色加深,变为棕黄色; iii.稍后,溶液由棕黄色变浅,最终变为黄色 |
(1)用浓盐酸和MnO2反应制取Cl2的化学方程式是 。
(2)pH≈4的原因是 (用化学用语表示)。
(3)现象i中溶液由浅绿色逐渐变黄。某学生猜测可能原因:①Cl2将Fe2+氧化为Fe3+,使溶液呈黄色;②Cl2将Br-氧化为Br2,使溶液呈黄色。证明原因①的实验方案是 ;证明原因②的实验方案是 。
(4)现象ⅱ中,溶液变为棕黄色。部分学生猜测①:可能是Cl2先将Fe2+氧化生成Fe3+,Cl2又继续氧化Br-生成Br2。部分学生猜测②:可能是Cl2先将Fe2+氧化生成Fe3+,Fe3+将Br-氧化生成Br2。某学生设计实验进行验证,请完成下列表格:
由此实验得出的结论是 。
| 试管 |
操作 |
现象 |
结论 |
| a |
取2 mL FeCl2溶液,滴加少量氯水、2滴KSCN溶液,振荡 |
|
Cl2的氧化性强于Fe3+ |
| b |
取2 mL FeCl3溶液,滴加少量溴化钠溶液和少量CCl4,振荡 |
CCl4层没有明显变化 |
|
| c |
|
CCl4层由无色变为橙黄色 |
Cl2的氧化性强于Br2 |
 粤公网安备 44130202000953号
粤公网安备 44130202000953号