铁、氯、铜及其化合物在生产、生活中有广泛的用途,试回答下列问题。
(1)二氧化氯(C1O2)已逐步代替C12用于自来水处理,用C1O2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(C1O2-)。已知:25℃时Ka(HClO)=3.2×10-8,Ka(HClO2)=1.0×10-2,则酸性强弱关系为 ;在pH=5的上述处理过的饮用水中 = 。若饮用水中C1O2-的含量超标,可向其中加入适量的Fe2+将C1O2-还原成Cl一,写出酸性条件下该反应的离子方程式: 。
= 。若饮用水中C1O2-的含量超标,可向其中加入适量的Fe2+将C1O2-还原成Cl一,写出酸性条件下该反应的离子方程式: 。
(2)①腐蚀铜板后的溶液中,若Cu2+、Fe3+和Fe2+浓度均为0.1 mol/l,如图为金属离子的浓度的对数与溶液pH的关系,现向混合溶液中通入氨气调节溶液的pH=5.6时,溶液中存在的金属阳离子为 。(当溶液中金属离子浓度≤10-5mol/l时,可认为沉淀完全)。
②从图中数据计算可得Fe(OH)2的溶度积Ksp[Fe(OH)2] 。
②Na2S是常用的沉淀剂。某工业污水中含有等浓度的
Cu2+、Fe2+、Pb2+,滴加Na2S溶液后首先析出的沉淀是 ;当最后一种离子沉淀完全时(该离子浓度为10-5m01/l),此时的S2一的浓度为 。
已知:Ksp(FeS)=6.3×10-18(mol•L-1)2,Ksp(CuS)=6×10-36(mol•L-1)2,Ksp(PbS)=2.4×10-28(mol•L-1)2

 a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)
a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)

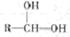 会自动脱水形成R—CHO
会自动脱水形成R—CHO 和足量NaOH反应,最多能消耗___________mol NaOH。
和足量NaOH反应,最多能消耗___________mol NaOH。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号