根据下列流程处理废旧电路板来回收金属Cu,并制得高铁酸钾(K2 FeO4)。
据此回答问题: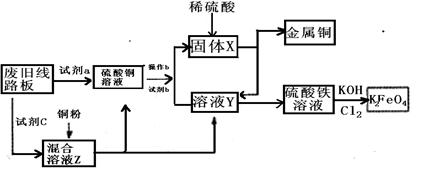
(1)试剂a最好为 ,试剂b为 (填写所选试剂代号)
| A.浓硫酸 | B.硫酸铁溶液 | C.氯水 | D.H2O2和稀硫酸 E.Fe |
(2)溶液Z中金属离子可能有Cu2+、Fe2+、Fe3+,检验Fe3+的试剂为 (填化学式);欲测定溶液Z中Fe2+的浓度,需要用 (填主要仪器名称)配制500ml 0.1mol/L的KMnO4标准溶液进行滴定,在滴定时KMnO4标准溶液应加入到____________(填“酸式”或“碱式”)滴定管中,滴定终点时的现象是 。
(3)溶液Y的水溶液显 性,原因是 (用离子方程式表示)。
(4)K2FeO4是强氧化剂,目前水处理通常用K2FeO4理由是 。
生成K2FeO4的离子方程式是
(5)室温时向Fe2(SO4)3溶液中滴加NaOH溶液,若要使Fe3+完全沉淀,则所需溶液的pH值至少为 (已知Ksp(Fe(OH)3=1.0×10-38 )

 CO2(g) + 3H2(g)
CO2(g) + 3H2(g)  H(298K)=+ 49.4 kJ/mol
H(298K)=+ 49.4 kJ/mol 粤公网安备 44130202000953号
粤公网安备 44130202000953号