(1)氢是未来最好的能源选择,制取氢气的成熟的方法有很多,利用甲醇可以与水蒸气反应生成氢气,反应方程式如下:
CH3OH(g) + H2O(g)  CO2(g) + 3H2(g)
CO2(g) + 3H2(g) 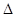 H(298K)=+ 49.4 kJ/mol
H(298K)=+ 49.4 kJ/mol
一定条件下,向容积为2L的恒容密闭容器中充入1 mol CH3OH(g)和3 mol H2O(g),实验测得:达到平衡状态时,吸收热量19.76 kJ。则
①达平衡时混合气体的压强是反应前的 倍。
②该条件下的该反应的平衡常数是 (结果保留两位有效数字)。
③该条件下反应达平衡状态的依据是(填序号) 。
| A.v正(CH3OH)=v正(CO2) | B.混合气体的密度不变 |
| C.c(CH3OH)=c(H2O) | D.混合气体的总物质的量不变 |
(2) 甲、乙两容器体积相等,甲容器通入1 mol SO2和1 mol O2,乙容器通入1 mol SO3和0.5 mol O2,发生反应:2SO2(g) + O2 (g)  2SO3(g)
2SO3(g) 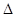 H<0,甲、乙起始反应温度相同,均和外界无热量交换,平衡时,甲中SO2的转化率为a,乙中SO3的分解率为b,则a、b的关系为a+b _______ 1(填“﹤”、“﹥”或“=”) 。
H<0,甲、乙起始反应温度相同,均和外界无热量交换,平衡时,甲中SO2的转化率为a,乙中SO3的分解率为b,则a、b的关系为a+b _______ 1(填“﹤”、“﹥”或“=”) 。

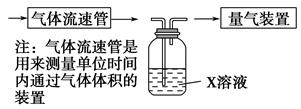
 的转化率,已知气体流速,还需测定的数据有、。
的转化率,已知气体流速,还需测定的数据有、。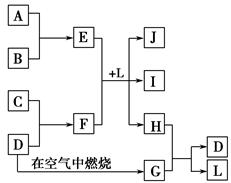

 粤公网安备 44130202000953号
粤公网安备 44130202000953号