氢氧化钾是重要的工业产品。请回答:
(1)铝与氢氧化钾溶液反应的离子方程式是 。
(2)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。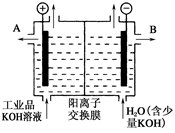
①该电解槽的阳极反应式是 。
②通电开始后,阴极附近溶液pH会增大,请简述原因: 。
③除去杂质后的氢氧化钾溶液从液体出口 (填写“A”或“B”)导出。
氢氧化钾是重要的工业产品。请回答:
(1)铝与氢氧化钾溶液反应的离子方程式是 。
(2)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
①该电解槽的阳极反应式是 。
②通电开始后,阴极附近溶液pH会增大,请简述原因: 。
③除去杂质后的氢氧化钾溶液从液体出口 (填写“A”或“B”)导出。