江苏省高三百校联合调研测试(一)化学试卷
化学与新型材料、环境保护、能源开发等密切相关。下列说法错误的是
| A.人造纤维、合成橡胶和光导纤维都属于有机高分子化合物 |
| B.使用生物酶降解生活废水中的有机物,可防止水体的富营养化 |
| C.上海世博会很多展馆采用光电转化装置,体现当今“低碳”经济的理念 |
| D.利用二氧化碳等原料合成聚碳酸酯类可降解塑料,有利于减少白色污染 |
下列有关化学用语或名称表达正确的是
A.亚硫酸的电离方程式:H2SO3 2H++SO32- 2H++SO32- |
B.乙炔的分子结构模型示意图: |
C.H2O2的电子式: |
D. 的名称3-甲基-1-丁醇 的名称3-甲基-1-丁醇 |
下列有关物质的性质和该性质的应用均正确的是
| A.SO2具有氧化性,可用于漂白纸浆 |
| B.炭具有还原性,一定条件下能将二氧化硅还原为硅 |
| C.BaCO3、BaSO4都难溶于水,均可用做钡餐 |
| D.Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚 |
常温下,下列各组离子在指定溶液中能大量共存的是
| A.pH=1的溶液中:Fe3+、Cl-、NO3-、K+ |
| B.滴入酚酞显红色的溶液中:Na+、Mg2+、AlO2-、NO3- |
| C.加入铝粉产生H2的溶液中:Fe2+、Na+、SO42-、ClO- |
| D.c(SO32-)=0.1 mol·L-1的溶液中:Na+、Cl-、H+、Ca2+ |
下列有关实验装置的说法中正确的是



| A.用图1装置制取干燥纯净的NH3 |
| B.用图2装置实验室制备Fe(OH)2 |
| C.用图3装置可以完成“喷泉”实验 |
| D.用图4装置测量Cu与浓硝酸反应产生气体的体积 |
设NA为阿伏加德罗常数的值。下列叙述正确的是
| A.0.1 mol Cl2全部溶于水后转移电子的数目为0.1NA |
| B.标准状况下,0.56 L丙烷中含有共价键的数目为0.2NA |
| C.25℃时,1 L pH=12的Na2CO3溶液中含有Na+的数目为0.02NA |
| D.常温常压下,14 g C2H4、C3H6的混合气体中含有碳原子的数目为NA |
下表各组物质中,物质之间不可能实现如图所示转化的是
| 选项 |
X |
Y |
Z |
M |
| A |
NH3 |
NO |
NO2 |
O2 |
| B |
Cl2 |
FeCl3 |
FeCl2 |
Fe |
| C |
Al |
Al(OH)3 |
NaAlO2 |
NaOH |
| D |
NaOH |
Na2CO3 |
NaHCO3 |
CO2 |
下列说法中用离子方程式表达正确的是
A.用惰性电极电解氯化钠溶液:2Cl-+2H+ H2↑+Cl2↑ H2↑+Cl2↑ |
| B.向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3 ↓+CO32- |
| C.Fe(NO3)2溶液中滴加少量稀盐酸:Fe2++NO3-+4H+=Fe3++NO↑+2H2O |
| D.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-= CaCO3↓+H2O |
下列说法不正确的是
| A.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
| B.加热、蒸发MgCl2饱和溶液可得无水MgCl2晶体 |
| C.工业上用石灰乳对煤燃烧后形成的烟气进行脱硫,最终能制得石膏 |
| D.室温下,c(NH4+)相等的(NH4)2SO4、NH4HCO3、NH4Cl溶液中:c(NH4)2SO4<c(NH4Cl)<c(NH4HCO3) |
下列图示与对应的叙述相符的是



图甲 图乙 图丙 图丁
| A.由图甲表示的反应速率随温度变化的关系可知该反应的ΔH>0 |
| B.图乙表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是醋酸 |
| C.图丙表示该反应为放热反应,且催化剂能改变反应的焓变 |
| D.图丁表示向Na2CO3溶液中逐滴滴加稀盐酸,生成CO2与所加盐酸物质的量的关系 |
某有机物Z具有较广泛的抗菌作用,其生成机理可由X与Y相互作用:


X Z
下列有关叙述中不正确的是
| A.Z结构中有4个手性碳原子 |
| B.Y的分子式为C9H8O3 |
| C.1 mol Z与足量NaOH溶液反应,最多消耗8 mol NaOH |
| D.Z与浓溴水既能发生取代反应又能发生加成反应 |
X、Y、Z、W为四种短周期主族元素,它们在周期表中的相对位置如图所示。Z元素原子核外K层与M层电子数相等。下列说法中正确的是
| |
|
X |
Y |
| Z |
W |
|
|
A.Y元素最高价氧化物对应的水化物化学式为H2YO3
B.原子半径由小到大的顺序为:Y<X<W<Z
C.室温下,Z和W的单质均能溶于浓硝酸
D.X、Z两种元素的氧化物中所含化学键类型相同
下列实验操作、现象与结论对应关系正确的是
| 选项 |
实验操作 |
实验现象 |
结论 |
| A |
向盛有Fe(NO3)2溶液的试管中加入0.1 mol·L-1 H2SO4溶液 |
试管口出现红棕色气体 |
溶液中NO3-被Fe2+还原为NO2 |
| B |
向溶液中先滴加稀盐酸,再滴加BaCl2溶液 |
先滴加稀盐酸无现象,滴加BaCl2后出现白色沉淀 |
溶液中一定含有SO42- |
| C |
在0.1 mol·L-1 Na2CO3溶液中,加两滴酚酞显浅红色,微热 |
红色加深 |
盐类水解是吸热反应 |
| D |
向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2悬浊液,加热 |
无砖红色沉淀生成 |
淀粉没有水解生成葡萄糖 |
25℃时,有c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示。下列有关溶液中离子浓度关系的叙述正确的是
| A.Y点所表示的溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
| B.W点所表示的溶液中:c(Na+)+c(H+)+c(OH-)+c(CH3COOH)=0.1mol·L-1 |
| C.该温度下醋酸的电离平衡常数为10—4.75 mol·L-1 |
| D.向X点所表示的溶液中加入等体积的0.05 mol·L-1 NaOH溶液 :c(H+)=c(CH3COOH)+c(OH-) |
温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g) PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据如图:
PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据如图:
下列说法正确的是
| A.反应在前50 s 的平均速率v(PCl3)=0.0032 mol·L-1·s-1 |
| B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol·L-1,则反应的△H<0 |
| C.相同温度下,起始时向容器中充入2.0 mol PCl3和2.0mol Cl2,达到平衡时,PCl3的转化率小于80% |
| D.相同温度下,起始时向容器中充入1.0 mol PCl5、0.20mol PCl3和0.20 mol Cl2,反应达到平衡前v(正)>v(逆) |
二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产ClO2的工艺主要包括:①粗盐精制;②电解微酸性NaCl溶液;③ClO2的制取。工艺流程如下图: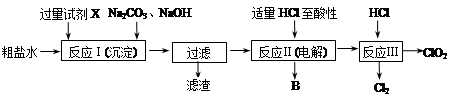
(1)粗食盐水中含有Ca2+、Mg2+、SO42-等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,X是 (填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO42-,其原因是 。(已知:Ksp(BaSO4)=1.1×10-10;Ksp(BaCO3)=5.1×10-9)
(2)上述过程中,将食盐水在特定条件下电解得到的氯酸钠与盐酸反应生成ClO2。电解时生成的气体B是 ;反应Ⅲ的化学方程式为 。
(3)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知:ClO2+I-+H+—I2+Cl-+H2O 未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知:I2+2S2O32-=2I-+S4O62-)
① 准确量取10.00 mL ClO2溶液的玻璃仪器是 。
② 滴定过程中,至少须平行测定两次的原因是 。
③ 根据上述步骤可计算出原ClO2溶液的物质的量浓度为 mol·L-1(用含字母的代数式表示)。
某研究小组以甲苯为主要原料,采用以下路线合成医药中间体F和Y。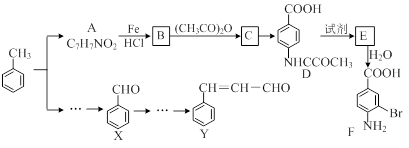
已知:①


②2CH3CHO  CH3CH(OH)CH2CHO
CH3CH(OH)CH2CHO 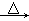 CH3CH=CHCHO
CH3CH=CHCHO
请回答下列问题:
(1)下列有关F的说法正确的是 。
| A.分子式是C7H7NO2Br |
| B.能形成内盐 |
| C.能发生取代反应和缩聚反应 |
| D.1 mol的 F最多可以和2 mol NaOH反应 |
(2)C→ D的反应类型是 。
(3)B→C的化学方程式是 。
在合成F的过程中,B→C步骤不能省略,理由是 。
(4)D→E反应所需的试剂是 。
(5)写出同时符合下列条件的A的同分异构体的结构简式 (写出3个)。
①苯环上只有两种不同化学环境的氢原子
②分子中含有 -CHO
(6)以X和乙烯为原料可合成Y,请设计合成路线(无机试剂及溶剂任选)。
注:合成路线的书写格式参照如下示例流程图:
CH3CHO  CH3COOH
CH3COOH 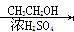 CH3COOCH2CH3
CH3COOCH2CH3
硫酸用途十分广泛,工业上合成硫酸时,将SO2转化为催化氧化是一个关键步骤。请回答下列问题:
(1)该反应在恒温恒容密闭容器中进行,判断其达到平衡状态的标志是 。(填字母)
a.SO2和SO3浓度相等
b.SO2百分含量保持不变
c.容器中气体的压强不变
d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)某温度下,2SO2(g)+O2(g) 2SO3(g) △H=-196 kJ•mol-1。在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3为0.18 mol,则v(O2)= mol•L-1•min-1,放出的热量为 kJ。
2SO3(g) △H=-196 kJ•mol-1。在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3为0.18 mol,则v(O2)= mol•L-1•min-1,放出的热量为 kJ。
(3)一定温度时,SO2的平衡转化率(α)与体系总压强(p)的关系如图所示。试分析工业生产中采用常压的原因是 。
(4)将一定量的SO2和0.7 molO2放入一定体积的密闭容器中,在550℃和催化剂作用下发生反应。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28 L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。则该反应达到平衡时SO2的转化率是多少?(要写出计算过程,计算结果保留一位小数。)
铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等。


(1)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图甲)进行铝热反应,现象很壮观。取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变血红色。出现这种现象的原因,除了可能混有没反应完的磁性氧化铁外,还有一个原因是 。
(2)若证明上述所得“铁块”中含有金属铝,可选择 (填试剂名称),所发生反应的离子方程式为 。
(3)为克服图甲的缺陷改用图乙装置进行铝热反应。取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色。为测定该实验所得 “铁块”的成分,实验流程如图所示。
几种氢氧化物开始沉淀和完全沉淀的pH如下表所示。
| |
Fe2+ |
Fe3+ |
Al3+ |
Mg2+ |
| 开始沉淀时的pH |
7.5 |
2.8 |
4.2 |
9.6 |
| 沉淀完全时的pH |
9.0 |
4.0 |
5 |
11 |
① 试剂A应选择 ,试剂B应选择 。(填序号)
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水 E.MgCO3固体
② 已知常温下Fe(OH)3的Ksp=1.1×10-36,则反应Ⅲ后溶液中c(Fe3+)= mol·L-1。
③ 灼烧完全的标志是 。
④ 若最终红色粉未M的质量为12.0 g,则该“铁块”的纯度是 。如果对所得过滤固体直接洗涤、烘干、称量,计算“铁块”的纯度,则计算结果会 (填“偏大”“偏小”或“无影响”),原因是 。
中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3 |
Cl- |
| 浓度/mol•L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据计算PM2.5待测试样的pH = 。
(2)NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
① N2(g)+O2(g) 2NO(g) △H= 。
2NO(g) △H= 。
② 当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式 。
③ 汽车汽油不完全燃烧时还产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g),已知该反应的△H>0,该设想能否实现? 。你的依据是 。
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
①用离子方程式表示反应器中发生的反应 。
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是 。
③用吸收H2后的稀土储氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池。电池充放电时的总反应为:Ni(OH)2+M NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极电极反应式为 。
NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极电极反应式为 。
已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大。元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K位于ds区且原子的最外层电子数与X的相同。
请回答下列问题:(答题时,X、Y、Z、W、K用所对应的元素符号表示)
(1)Y、Z、W元素的第一电离能由大到小的顺序是 。
(2)K的电子排布式是 。
(3)Y、Z元素的某些氢化物的分子中均含有18个电子,则Y的这种氢化物的化学式是 ;Y、Z的这些氢化物的沸点相差较大的主要原因是
(4)若X、Y、W形成的某化合物(相对分子质量为46)呈酸性,则该化合物分子中Y原子轨道的杂化类型是 ;1 mol该分子中含有 σ键的数目是 。
(5)Z、K两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是 ,Z原子的配位数是 。
乳酸乙酯(2-羟基丙酸乙酯)常用于调制果香型、乳香型食用和酒用香精。为了在实验室制取乳酸乙酯,某研究性学习小组同学首先查阅资料,获得下列信息:
①部分物质的沸点:
| 物 质 |
水 |
乙醇 |
乳酸 |
苯 |
乳酸乙酯 |
| 沸点/℃ |
100 |
78.4 |
122 |
80.10 |
154 |
②乳酸乙酯易溶于苯、乙醇;水、乙醇、苯的混合物在64.85℃时,能按一定的比例以共沸物的形式一起蒸发。
该研究性学习小组同学拟采用如图所示(未画全)的主要装置制取乳酸乙酯,其主要实验步骤如下: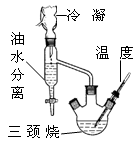
第一步:在三颈烧瓶中加入0.1mol无水乳酸、过量的65.0mL无水乙醇、一定量的苯、沸石……;装上油水分离器和冷凝管,缓慢加热回流至反应完全。
第二步:将三颈烧瓶中液体倒入盛有过量某试剂的烧杯中,搅拌并分出有机相后,再用水洗。
第三步:将无水CaCl2加入到水洗后的产品中,过滤、蒸馏。
(1)第一步操作中,还缺少的试剂是 ;加入苯的目的是 ;实验过程中,酯化反应进行完全的标志是 。
(2)第二步中证明“水洗”已经完成的实验方案是 。
(3)第三步可以得到较纯净的乳酸乙酯,为获得更纯净的乳酸乙酯,可采用 法。
(4)利用核磁共振氢谱可以鉴定制备的产物是否为乳酸乙酯,乳酸乙酯分子核磁共振氢谱中有 个峰。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号