已知溶液中存在平衡:Ca(OH)2 (s)  Ca2+(aq)+2OH-(aq) ΔH<0。下列有关该平衡体系的叙述正确的是( )
Ca2+(aq)+2OH-(aq) ΔH<0。下列有关该平衡体系的叙述正确的是( )
| A.升高温度,固体的量减少 |
| B.加入少量Na2CO3粉末能增大钙离子的浓度 |
| C.降低温度,溶液中c(OH-)增大 |
| D.恒温下加入少量CaO,溶液的pH增大 |
在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10,下列说法不正确的是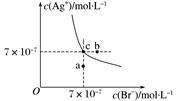
| A.在t ℃时,AgBr的Ksp为4.9×10-13 |
| B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点变到b点 |
| C.图中a点对应的是AgBr 的不饱和溶液 |
D.在t ℃时,AgCl(s)+Br-(aq)  AgBr(s)+Cl-(aq)的平衡常数K≈816 AgBr(s)+Cl-(aq)的平衡常数K≈816 |
向5mLNaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为淡黄色,再滴加一滴Na2S溶液并振荡,沉淀又变为黑色,根据上述变化过程,分析此三种沉淀物的溶解度关系是( )
| A.AgCl=AgI=Ag2S | B.AgI> AgCl> Ag2S |
| C.AgCl>AgI>Ag2S | D.AgCl<AgI<Ag2S |
已知25 ℃时,BaCO3的溶度积Ksp=2.58×10-9,BaSO4的溶度积Ksp=1.07×10-10,则下列说法不正确的是
| A.25 ℃时,当溶液中c(Ba2+)·c(SO42-)=1.07×10-10时,此溶液为BaSO4的饱和溶液 |
| B.25 ℃时,在含有BaCO3固体的饱和溶液中滴入少量Na2SO4溶液后有BaSO4沉淀析出,此时溶液中c(CO)∶c(SO)≈24.11 |
| C.因为Ksp(BaCO3)>Ksp(BaSO4),所以无法将BaSO4转化为BaCO3 |
| D.在饱和BaCO3溶液中加入少量Na2CO3固体,可使c(Ba2+)减小,BaCO3的溶度积不变 |
下表是五种银盐的溶度积常数(25 ℃),下列有关说法错误的是
| 化学式 |
AgCl |
Ag2SO4 |
Ag2S |
AgBr |
AgI |
| 溶度积 |
1.8×10-10 |
1.4×10-5 |
6.3×10-50 |
7.7×10-13 |
8.5×10-16 |
A.五种物质在常温下溶解度最大的是Ag2SO4
B.将AgCl溶解于水后,向其中加入Na2S,则可以生成黑色的Ag2S沉淀
C.沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动
D.常温下,AgCl、AgBr和AgI三种物质的溶解度逐渐增大
已知Ksp (AgCl)=1.8×10-10,Ksp(AgI)=1.0 ×10-16。下列关于难溶物之间转化的说法中错误的是
| A.AgCl难溶于水,不能转化为AgI |
| B.同一类型难溶物的Ksp相差越大,难溶物就越容易转化为更难溶的物质 |
| C.常温条件下,将饱和的AgCl溶液和AgI溶液等体积混合,会有沉淀生成 |
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须大于(1/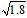 )×10-11mol/L )×10-11mol/L |
某无色透明溶液,可能含有下列离子:Mg2+、Al3+、Fe3+、Ba2+、H+、NH4+、SO42-、HCO3-、Cl-、CO32-。取该溶液进行如下实验:
①取溶液少许,滴入AgNO3溶液产生白色沉淀;
②另取溶液少许,滴入BaCl2溶液产生白色沉淀,加入足量稀硝酸沉淀不溶解;
③另取原溶液500mL,加入过氧化钠固体,产生的沉淀的物质的量与加入过氧化钠的物质的量的关系如下图所示。

根据实验现象和数据分析,回答下列问题:
(1)de段发生的反应的离子方程式是 ;
(2)溶液中肯定存在的离子是 (用离子符号表示);
(3)溶液中可能存在的离子是 (用离子符号表示);
(4)原溶液中金属阳离子的浓度分别为 ;
(5)请在答题卡对应图上画出加入过氧化钠从0~1.1mol时,产生气体的物质的量随加入过氧化钠物质的量变化的曲线(假设生成的气体全部逸出)。
常温下,在BaSO4饱和溶液中加入Na2SO4固体,达到溶解平衡时,下列说法正确的是
| A.c (Ba2+) =" c" (SO42-) |
| B.c (Ba2+) 增大,c(SO42-) 减小 |
| C.c (Ba2+) ≠ c (SO42-),c(Ba2+)·c(SO42-) = KSP (BaSO4) |
| D.c (Ba2+) ≠ c (SO42-),c(Ba2+)·c(SO42-) ≠ KSP (BaSO4) |
己知Ksp(AgCl) =1.56×10-10,Ksp(AgBr) =7.7×10-13,Ksp(Ag2CrO4)=9×10-12。某溶液中含有Cl-、Br-和CrO42-,浓度均为0.0l0mol/L,向该溶液中逐滴加入0.0l0mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
| A.Cl-、Br-、CrO42- | B.CrO42-、Br-、Cl- |
| C.Br-、Cl-、CrO42- | D.Br-、CrO42-、Cl- |
用
滴定
溶液的滴定曲线如图所示。下列有关描述错误的是( )

| A. | 根据曲线数据计算可知 的数量级为 |
B. | 曲线上各点的溶液满足关系式 |
| C. | 相同实验条件下,若改为 , 反应终点c移到a |
D. | 相同实验条件下,若改为 , 反应终点c向b方向移动 |
已知:Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16 ,Ksp(AgBr)=7.7×10-13,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是
| A.AgCl>AgI> AgBr | B.AgBr >AgI>AgCl |
| C.AgBr >AgCl>AgI | D.AgCl> AgBr>AgI |
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图。下列叙述正确的是( )
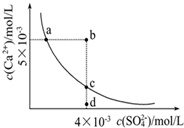
①a、c两点均可以表示CaSO4溶于水所形成的饱和溶液;②a点对应的Ksp不等于c点对应的Ksp;③b点对应的溶液将有沉淀生成;④向d点溶液加入适量的CaCl2固体可以变到c点;⑤d点溶液通过蒸发溶剂可以变到c点;⑥常温下CaSO4溶于水的饱和溶液中,c(Ca2+)与c(SO42-)的乘积对应曲线上任意一点;⑦常温下,向100mL饱和CaSO4溶液中加入400mL0.01mol/L Na2SO4溶液,能使溶液由a点变为b点
| A.2句 | B.3句 | C.4句 | D.5句 |
向盛有0.1mol/LAgNO3溶液的试管中滴加 0.05mol/LNa2S溶液至沉淀完全,再向上层清液中滴加足量 NaCl,产生的现象及发生的反应是
| A.黑色沉淀完全转化为白色沉淀 | B.既有Ag2S也有 AgCl |
| C.不能由黑色沉淀转变为白色沉淀 | D.只有 AgCl白色沉淀 |
下列叙述或表示正确的是( )
| A.0.1mol·L﹣1的醋酸的pH=a,0.01mol·L﹣1的醋酸的pH=b,则a+1=b |
| B.常温下0.1mol·L﹣1的醋酸溶液与等浓度等体积NaOH溶液反应后的溶液中:c(CH3COOH)+c(CH3COO﹣)=0.1mol·L﹣1 |
| C.难溶电解质AB2的饱和溶液中,已知:c(A2+)="x" mol·L﹣1,c(B﹣)="y" mol·L﹣1,则Ksp值为4xy2 |
| D.用200mL4mol·L﹣1的NaOH溶液将0.6mol CO2完全吸收,反应的离子方程式为: 3CO2+4OH﹣=CO32﹣+2HCO3﹣+H2O |