在四个不同的容器中,在不同的条件下进行合成氨反应。根据在相同时间内测定的结果判断,生成氨的速率最快的是:
| A.υ(H2)="0.1" mol·L-1·s-1 | B.υ(N2)="0.2" mol·L-1·min-1 |
| C.υ(NH3)="0.15" mol·L-1·min-1 | D.υ(H2)="0.3" mol·L-1·min-1 |
在2A + B =" 3C" + 4D的反应中,下列表示该反应速率最大的是( )
| A.VA =0.5mol / (L.min) | B.VB =0.3mol / (L.min) |
| C.VA =0.8mol / (L.min) | D.VD =" 1mol" / (L.min) |
25℃、101kPa 下:①2Na(s)+1/2O2(g)=Na2O(s) △H1=-414KJ/mol
②2Na(s)+O2(g)=Na2O2(s) △H2=-511KJ/mol
下列说法正确的是( )
| A.①和②产物的阴阳离子个数比不相等 |
| B.①和②生成等物质的量的产物,转移电子数不同 |
| C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 |
| D.25℃、101kPa下,Na2O2(s)+2Na(s)=2Na2O(s)△H=-317kJ/mol |
在2A(g)+B(g) 3C(g)+4D(g)反应中,表示该反应速率最快的是( )
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A.v(A)="0.3mol/L·" s B.v(B)="0.3mol/L·" s
C.v(C)="0.3mol/L·" s D.v(D)="1mol/L·" s
下列措施能明显增大原反应的化学反应速率的是
| A.Na与水反应时增大水的用量 |
| B.将稀H2SO4改为98%的浓H2SO4与Zn反应制取H2 |
| C.在H2SO4与NaOH两溶液反应时,增大压强 |
| D.恒温恒容条件下,在工业合成氨反应中,增加氮气的量 |
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020 mol·L-1的NaHSO3溶液(含少量淀粉)10.0 mL、KIO3(过量)酸性溶液40.0 mL混合,记录10~55℃间溶液变蓝时间,55 ℃时未观察到溶液变蓝,实验结果如下图。据图分析,下列判断不正确的是( )

| A.40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 |
| B.当NaHSO3消耗时的离子方程式为:5HSO3-+2IO3-=5SO42-+I2+3H++H2O |
| C.图中a点对应的NaHSO3反应速率为5.5×10-5 mol·L-1·s-1 |
| D.温度高于40℃时,淀粉不宜用作该实验的指示剂 |
已知A(g)+3B(g)=2C(g)+2D(g),若反应速率分别用ν(A)、ν(B)、ν(C)、ν(D)表示,下列反应速率中最快的是
A.ν(A)= 0.15mol·L-1·s-1
B.ν(B)= 0.60mol·L-1·s-1
C.ν(C)=" 0.40" mol·L-1·s-1
D.ν(D)= 0.45mol·L-1·s-1
据《读卖新闻》报道,日本海洋研究开发机构正在开发一项使用镍催化剂将二氧化碳转化成甲烷的新技术。实验室模拟该过程的反应如下:CO2(g)+4H2(g) CH4(g)+2H2O(g),向一个固定容积为2L的密闭容器中充入一定量的CO2和H2,在300℃下发生上述反应,10min后达平衡时各物质的浓度分别为:CO2 0.2 mol•L-1,H2 0.8 mol·L-1,CH4 0.8 mol•L-1。下列说法不正确的是
CH4(g)+2H2O(g),向一个固定容积为2L的密闭容器中充入一定量的CO2和H2,在300℃下发生上述反应,10min后达平衡时各物质的浓度分别为:CO2 0.2 mol•L-1,H2 0.8 mol·L-1,CH4 0.8 mol•L-1。下列说法不正确的是
| A.反应速率υ(H2)=0.16mol•L-1•min-1 |
| B.容器体积扩大为4L,平衡向逆反应方向移动 |
| C.向体系中再充入1molH2,CO2的转化率增大 |
| D.此条件下该可逆反应的平衡常数的数值K=25 |
在一定条件下,对于A2(g)+3B2(g) 2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
| A.v(A2)=0.8 mol·L-1·s-1 | B.v(A2)=30 mol·L-1·min-1 |
| C.v(AB3)=1.0 mol·L-1·s-1 | D.v(B2)=1.2 mol·L-1·s-1 |
反应2SO2+O2  2SO3(g)经一段时间后,SO3的浓度增加了0.4 mol/L,在这段时间内用O2表示的反应速率为0.04 mol•L-1•s-1,则这段时间为
2SO3(g)经一段时间后,SO3的浓度增加了0.4 mol/L,在这段时间内用O2表示的反应速率为0.04 mol•L-1•s-1,则这段时间为
| A. 0.1 s | B. 2.5 s | C. 5 s | D. 10 s |
反应4NH3(气)+5O2(气) 4NO(气)+6H2O(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率
4NO(气)+6H2O(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率  (X)(反应物的消耗速率或产物的生成速率)可表示为
(X)(反应物的消耗速率或产物的生成速率)可表示为
A. (NH3) =" 0.010" mol/(L·s) (NH3) =" 0.010" mol/(L·s) |
B. (O2) =" 0.0010" mol/(L·s) (O2) =" 0.0010" mol/(L·s) |
C. (NO) =" 0.0010" mol/(L·s) (NO) =" 0.0010" mol/(L·s) |
D. (H2O) =" 0.045" mol/(L·s) (H2O) =" 0.045" mol/(L·s) |
在2A+B 3C+4D反应中,表示该反应速率最快的是
3C+4D反应中,表示该反应速率最快的是
A.υ(A)= 0.5 mol/(L·s) B.υ(B)= 0.3 mol/(L·s)
C.υ(C)= 0.8 mol/(L·s) D.υ(D)= 1 mol/(L·s)
在容积为2L的密闭容器中进行反应:CO(g)+2H2(g) CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是
CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是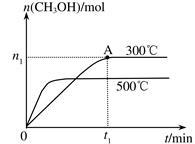
| A.该反应的△H>0 |
| B.其他条件不变,升高温度反应的平衡常数增大 |
| C.300℃时,0-t1min内 CH3OH的平均生成速率为n1/2t1 mol·L-1 min-1 |
| D.A点的反应体系从300℃升高到500℃,达到平衡时n(H2)/n(CH3OH)减小 |
在密闭容器中进行反应CH4(g)+H2O(g) CO(g)+3H2(g)ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断不正确的是
CO(g)+3H2(g)ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断不正确的是
| A.10 min时,改变的外界条件可能是升高温度 |
| B.0~10 min内,v(H2)=0.15 mol·L-1·min-1 |
| C.恒温下,缩小容器体积,一段时间内v(逆)>v(正) |
| D.12 min时,反应达平衡的本质原因是气体总质量不再变化 |