2A(g)+B(g)  3C(g)+4D(g)的反应,在不同条件下的反应的速率最快的是
3C(g)+4D(g)的反应,在不同条件下的反应的速率最快的是
A.v(A) = 0.7mol·L-1·min-1 B.v(B) = 0.3mol·L-1·min-1
C.v(C) = 0.9mol·L-1·min-1 D.v(D) = 1.1mol·L-1·min-1
可逆反应2A(g)+3B(g)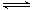 2C(g)+D(g)在四种不同条件下的反应速率分别为:
2C(g)+D(g)在四种不同条件下的反应速率分别为:
①v(A)=0.5mol/(L·min) ②v(B)="0.6" mol/(L·min)
③v(C)="0.3" mol/(L·min) ④v(D)="0.4" mol/(L·min)
则该反应在不同条件下反应速率最快的是( )
A.④ B.③ C.② D.①
已知4NH3(g)+5O2(g)=4NO(g)+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列关系正确的是( )
| A.4 v(NH3)="5" v(O2) | B.5v(O2)="6" v(H2O) |
| C.2 v(NH3)="3" v(H2O) | D.4v(O2)=" 5" v(NO) |
5.6g铁粉投入到足量的100mL2mol/L的稀硫酸中,2min时铁粉刚好溶解,下列表示这个反应的速率正确的是
| A.v(Fe)=0.5mol/(L•min) | B.v(H2SO4)=1mol/(L•min) |
| C.v(H2)=0.5mol/(L•min) | D.v(FeSO4)=0.5mol/(L•min) |
对于反应2SO2(g) +O2(g) 2SO3(g),能增大正反应速率的措施是
2SO3(g),能增大正反应速率的措施是
| A.通入大量O2 | B.增大反应容器容积 |
| C.移去部分SO3 | D.降低体系温度 |
一定温度下,反应N2(g)+O2(g)  2NO(g)在密闭容器中进行,下列措施不改变化学反应速率的是
2NO(g)在密闭容器中进行,下列措施不改变化学反应速率的是
| A.缩小体积 | B.恒容,充入He | C.恒容,充入O2 | D.恒压,充入N2 |
设吸热反应C+CO2  2CO的反应速率为v1,放热反应N2+3H2
2CO的反应速率为v1,放热反应N2+3H2  2NH3的反应速率为v2,当温度升高时,v1和v2的变化情况为
2NH3的反应速率为v2,当温度升高时,v1和v2的变化情况为
| A.同时增大 | B.同时减小 | C.增大,减小 | D.减小,增大 |
将0.5 mol SO2和0.2 mol O2置于密闭容器中发生反应:2SO2+O2 2SO3。下列关于该反应的说法正确的是
2SO3。下列关于该反应的说法正确的是
| A.最终可生成0.4 mol SO3 | B.当v正(O2)= v逆(SO2) = 0时一定达化学平衡 |
| C.升高温度反应速率减小 | D.缩小体积增大压强反应速率增大 |
下列说法一定正确的是
A.反应A(s)  2B(g) + C(g),当C的体积分数不变时,反应达到平衡状态 2B(g) + C(g),当C的体积分数不变时,反应达到平衡状态 |
| B.将钢闸门与直流电源的正极相连,可防止钢闸门腐蚀 |
| C.用FeS为沉淀剂除去废水中的Hg2+:FeS(s)+ Hg2+(aq)=HgS(s)+Fe2+(aq) |
| D.增大反应物浓度可加快反应速率,因此可用浓硫酸与铁反应增大生成氢气的速率 |
在四个不同的容器中,在不同条件下进行合成氨反应。根据下列在相同时间内测定的结果判断生成氨的速率最快的是
| A.v(H2)=0.1mol·(L·min)-1 | B.v(N2)=0.1mol·(L·min)-1 |
| C.v(N2)=0.2mol·(L·min)-1 | D.v(NH3)=0.3mol·(L·s)-1 |
反应2SO2(g)+O2 (g) 2SO3(g) ,经一段时间后SO3的浓度增加了0.4 mol•L-1,在这段时间内用O2表示的反应速率为0.4mol•L-1•s-1 ,则这段时间为 ( )
2SO3(g) ,经一段时间后SO3的浓度增加了0.4 mol•L-1,在这段时间内用O2表示的反应速率为0.4mol•L-1•s-1 ,则这段时间为 ( )
| A.0.1s | B.2.5s | C.0.5s | D.10s |
一定温度下,在固定体积的密闭容器中发生下列反应:2HI(g)==H2(g)+I2(g)。若c(HI)由0.1 mol·L-1降到0. 07 mol·L-1时,需要15 s,那么c(HI)由0. 07 mol·L-1 降到0.05 mol·L-1时,所需反应的时间为
| A.等于5 s | B.等于10 s | C.大于10 s | D.小于l0 s |
反应A(g)+3B(g) 2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是( )
2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是( )
A.v(C)=0.04mol·(L·s)-1 B.v(B)=0.06mol·(L·s)-1
C.v(A)=0.03mol·(L·s)-1 D.v(D)=0.01mol·(L·s)-1