在2L的密闭容器中充入一定量的SO3,在一定温度和催化剂作用下,发生反应:2SO3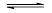 2SO2+O2,4min测得n(O2)=0.8mol,n(SO3)=6.4mol。
2SO2+O2,4min测得n(O2)=0.8mol,n(SO3)=6.4mol。
求:(1)n(SO2);
(2)氧气的生成速率v (O2);
(3)SO3的转化率;
向2L密闭容器中通入amol 气体A和bmol气体B,在一定条件下发生反应:
xA(g)+yB(g) 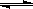 pC(g)+qD(g)
pC(g)+qD(g)
已知:平均反应速率vC=vA/2;反应2min 时,A的物质的量减少了1/3,B的物质的量减
少了a/2 mol,有a mol D生成。请计算回答:(写出计算过程)
(1)反应2min内,v(A) =__________________
(2)化学方程式中,x= 、y= 、p= 、q= 。
(3)平衡时,D为 2a mol,此时B的物质的量浓度为?
在一个容积为500毫升的密闭容器中,充入5molH2和2molCO,在一定温度和一定压强下发生如下反应:2H2(g )+CO(g)  CH3OH(g),经过5分钟后达到平衡状态,若此时测得CH3OH蒸汽的浓度为2mol/L,求:
CH3OH(g),经过5分钟后达到平衡状态,若此时测得CH3OH蒸汽的浓度为2mol/L,求:
(1)以H2的浓度变化表示的该反应的速率;
(2)达到平衡时CO的转化率;
(3)该温度下的K
一定温度下,在2L密闭容器中充入N2和H2合成NH3,其起始浓度分别为:c(N2)=2mol/L,c (H2 ) =3mol/L,此时压强为5.05×105Pa, 达平衡后测得NH3占总体积的25%。(1)求平衡时的压强;(2)平衡时混合气体对H2的相对密度。
在一个容积为500mL的密闭容器中,充入5mol H2和2 mol CO。在一定温度和一定压强下,发生如下反应在:2H2(g) +CO(g) CH3OH(g),经过5min后达到平衡状态。若此时测得容器内压强是起始时的4/7,求:(1)以H2的浓度变化表示的该反应的速率(2)达平衡时CO的转化率(3)该温度下的平衡常数K
CH3OH(g),经过5min后达到平衡状态。若此时测得容器内压强是起始时的4/7,求:(1)以H2的浓度变化表示的该反应的速率(2)达平衡时CO的转化率(3)该温度下的平衡常数K
(9分)在某温度下,将H2和I2各0.1 mol的气态混合物充入2 L的密闭容器中,充分反应,达到平衡后,测得C(HI)=0.02mol/L。
(1)求该反应的平衡常数;
(2)在上述温度下,陔容器中若通入H2和I2各4.0 mol的气态混合物,求达到化学平衡状态时各物质的浓度。
把2.5 mol A和2.5 mol B混合盛入2 L容积的密闭容器里发生反应3A(g)+B(g) x C(g)+ 2D(g),经5s后反应达平衡。在此5s内C的平均反应速率为0.
x C(g)+ 2D(g),经5s后反应达平衡。在此5s内C的平均反应速率为0. 2 m
2 m ol·L-1·s-1,同时生成1 mol D。试求:
ol·L-1·s-1,同时生成1 mol D。试求:
(1)试算x的值;
(2)达平衡时B的转化率;
(3)若达平衡时,该反应放出Q kJ的热量,写出该反应的热化学方程式;
(4)若温度和压强维持不变,达平衡时容器内气体的体积是多少?
计算题:(要求写出计算过程)现有一定温度下的密闭容器中存在如下反应:2SO2 (g) + O2(g)  2SO3(g) 已知c(SO2)始=0.4mol/L,c(O2)始=1mol/L经测定该反应在该温度下的平衡常数K≈19,试判断:
2SO3(g) 已知c(SO2)始=0.4mol/L,c(O2)始=1mol/L经测定该反应在该温度下的平衡常数K≈19,试判断:
(1)当SO2转化率为50%时,该反应是否达到平衡状态,若未达到,哪个方向进行?
(2)达平衡状态时, SO2的转化率应为多少?
已知850℃时,CO(g)+H2O(g) CO2(g)+H2(g)的K=1。850℃时,若在容积为2L的密闭容器中同时充入1.0mol CO,3.0mol H2O,1.0mol CO2和xmol H2。
CO2(g)+H2(g)的K=1。850℃时,若在容积为2L的密闭容器中同时充入1.0mol CO,3.0mol H2O,1.0mol CO2和xmol H2。
(1)当x=5.0时,判断化学反应进行的方向。
(2)若要使上述反应开始时向正反应方向进行,则x应满足的条件是什么?
(3)若x=5.0,当上述反应达到平衡后,计算H2的体积分数。
某温度下,将H2 和I2 各0.10mol的气态混合物充入10L的 密闭容器中,充分反应,经2分钟达到平衡,测得c(H2)=0.0080 mol•L-1。
密闭容器中,充分反应,经2分钟达到平衡,测得c(H2)=0.0080 mol•L-1。
(1)求:①H2转化为HI的转化率;②该反应的平衡常数。
(2)在上述温度下,该容器中若通入H2 和I2蒸气各0.20mol,试求达到化学平衡状态时各物质的浓度。
恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应: N2(g)+3H2(g) 2NH3(g)(注:要求每步均要写出计算过程)
2NH3(g)(注:要求每步均要写出计算过程)
(1)若反应进行到某时刻t时,nt(N2)="6.5" mol,nt(NH3)="3" mol,计算a的值。
(2)反应达平衡时,混合气体的体积为358.4 L(标况下),其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的量。
(3)平衡混合气体中,n(N2)∶n(H2)∶n(NH3)等于多少?
恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应: N2(g)+3H2(g) 2NH3(g)(注:要求每步均要写出计算过程)
2NH3(g)(注:要求每步均要写出计算过程)
(1)若反应进行到某时刻t时,nt(N2)="6.5" mol,nt(NH3)="3" mol,计算a的值。
(2)反应达平衡时,混合气体的体积为358.4 L(标况下) ,其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的
,其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的 量。
量。
(3)平衡混合气体中,n(N2)∶n(H2)∶n(NH3)等于多少?
将N2和H2按一定比例混合,在相同状况下其密度是H2的3.6倍,取0.5mol该混合气体通入密闭容器内,使之发生反应,并在一定条件下达到平衡,已知反应达到平衡后容器内压强是相同条件下反应前压强的0.76倍。试求:
(1)反应前混合气体中N2和H2的体积比;
(2)达平衡时混合气体中氨的物质的量;
(3)平衡时N2的转化率。
将 和
和 在适宜条件下按下式进行反应
在适宜条件下按下式进行反应

 ,当在某
,当在某 一温度下达到化学平衡状态,试解答:
一温度下达到化学平衡状态,试解答:
(1)若测得平衡混合气体对空气的相对密度为0.6时,求 的转化率.
的转化率.
(2)若测得平衡混合气体对空气的相对密度为0.47时,求 在平衡混合气体中体积分数.
在平衡混合气体中体积分数.